Tratamiento de alopecia androgenética con Sabal serrulata y péptidos biomiméticos vehiculizados con microneedling
with Sabal serrulata and biomimetic peptides
delivered with microneedling
Introducción
La alopecia es la pérdida reversible o irreversible de folículos pilosos previamente existentes con el resultado de la disminución de la densidad capilar de manera difusa o localizada1. La alopecia puede clasificarse de diversas maneras, según el origen y las manifestaciones, siendo la más común la alopecia androgenética (AGA), vulgarmente conocida como calvicie común. Este tipo de alopecia supone el 95% de los diagnósticos efectuados en clínica y es predominante en la raza caucásica. Afecta hasta un 80% de la población general masculina y a un 50% de la femenina en algún momento de su vida, siendo su prevalencia creciente con la edad2. La pérdida de cabello puede afectar a la autoestima y conducir a la depresión. La afectación de la calidad de vida y la elevada incidencia de AGA influyen en que sea la causa más frecuente de consulta en tricología3.
La AGA es una patología con base genética, de penetrancia variable y fisiopatología hormonal, que produce una miniaturización progresiva de los folículos del cuello cabelludo, principalmente en las zonas frontal, parietal y temporal1. La predisposición genética a la alopecia supone un 80% de los casos existentes4; el polimorfismo genético explica las diferentes edades de aparición y grados de presentación de la AGA5. La miniaturización folicular supone una respuesta de las células del folículo piloso a la tasa de andrógenos circulantes en sangre, en aquellos individuos con predisposición genética, aunque esta tasa sea normal6.
La testosterona se metaboliza en dihidrotestosterona (DHT), por la enzima 5‑alfareductasa (5‑αR), en sus formas de isoenzima 1 e isoenzima 2. La DHT tiene una gran afinidad por los receptores androgénicos del bulbo piloso, y es considerado el principal responsable de los efectos mediados por andrógenos en el cuero cabelludo de los pacientes con AGA7. Bajo la influencia de los andrógenos, la papila dérmica de los folículos pilosos secreta una cantidad importante de citoquinas, como TGF β‑1, IL‑1 α y TNFα que pueden incidir en el acortamiento de la fase anágena7.
La miniaturización folicular es una teoría que explica la disminución de la densidad del cuero cabelludo afectada por la AGA, lo que implica el acortamiento de la fase anágena en el ciclo del cabello, y una ascensión del folículo de la dermis reticular a la dermis papilar que ocurre progresivamente con cada nuevo ciclo de cabello. Las unidades foliculares, anteriormente más grandes y con pelos terminales, se reducen y exhiben un patrón de pelo velloso8. También explica la disminución de la densidad del cuero cabelludo afectada por la AGA.
Un gran número de señales moleculares están involucradas en las fases del ciclo normal del cabello. La transición de los folículos telógenos a anágenos se asocia con la activación de las vías de señalización Wnt/β catenina / LEF‑1 (Lymphoid enhancer-binding factor 1 – Factor de unión al potenciador linfoide), las proteínas exógenas Sonic Hedgehog (Shh) y las proteínas mediadoras STAT3 que actúan como mediadores en la expresión de genes en respuesta a determinados estímulos celulares, además de la regulación a la baja de la señalización de la proteína morfogenética ósea (BMP). El factor de crecimiento BMP‑4 también parece desempeñar un papel importante en la supresión del crecimiento y la diferenciación folicular durante la fase telógena. En la AGA los andrógenos circulantes ingresan al folículo a través de los capilares de la papila dérmica (DP), se unen al receptor de andrógenos dentro de las células de la DP y luego activan o reprimen las vías de señalización molecular responsable de la transición prematura de anágeno a catágeno y miniaturización folicular. Esto incluye la supresión de las vías estimulantes de Wnt, STAT 3 y Shh, y la regulación positiva de las vías supresoras como la BMP8‑10.
Otra explicación para la disminución de la densidad del cabello es el aumento de la duración de la fase kenógena, que puede ocurrir conjuntamente con el proceso de miniaturización. Es la denominada fase de folículo vacío que sigue a un evento exógeno que provoca caída de cabello. Esta fase kenógena puede durar de 3 meses a un año, pero en los casos de AGA puede ser más larga10. Un aumento de los folículos en esta fase puede ser más importante para la disminución del recuento de cabello que los folículos pilosos miniaturizados. Rushton et al concluyeron que, después de un tratamiento de la AGA de 12 meses, el cabello vuelve a crecer más por la conversión de los folículos de kenógena a anágena que por una mayor actividad en los folículos pilosos miniaturizados11.
A pesar de que la fisiopatología de la AGA está estrechamente relacionada con el metabolismo de los andrógenos, las evidencias científicas sugieren que también está asociada a la desregulación en la expresión de las citoquinas inflamatorias, con la consiguiente microinflamación crónica que actúa como factor agravante de la alopecia12. Este escenario inflamatorio puede ser causado por factores tanto endógenos como exógenos: flora bacteriana endógena en los casos asociados a seborrea, estrés oxidativo, envejecimiento, tabaquismo, radiación ultravioleta y contaminantes8. Respecto a los factores exógenos, la modificación del estilo de vida puede potencialmente disminuir la extensión de las manifestaciones clínicas7.
La utilización de la técnica de microneedling ha experimentado una importante evolución en los últimos años, lo que permite introducirla dentro del arsenal terapéutico como una herramienta de bajo coste, con una baja curva de aprendizaje, cómoda para el paciente y poco invasiva9,13‑16.
El dispositivo utiliza un cabezal de uso único con un número determinado de agujas finas macizas, conectado a un motor que produce la rotación de este cabezal y, en consecuencia, facilita las micropunciones cutáneas que generarán unos microcanales que atraviesan la capa externa de la piel, permitiendo el paso de pequeñas moléculas de sustancias activas. A su vez, estas micropunciones estimulan la neocolagénesis, la neovascularización, la expresión de las proteínas de Wnt y la liberación de factores de crecimiento17‑19. El microneedling puede utilizarse como tratamiento coadyuvante de la AGA, asociado a otras técnicas lumínicas, físicas o cosméticas con un excelente perfil de seguridad20.
Actualmente, los tratamientos de primera línea para la AGA en los varones son los fármacos antiandrógenos por vía oral, inhibidores de la 5‑α reductasa: dutasterida y finasterida; es de elección dutasterida pues inhibe las dos isoenzimas de la 5‑α reductasa, mientras que finasterida inhibe únicamente la isoenzima tipo 2. En diferentes ensayos clínicos, dutasterida ha mostrado que tiene un perfil de seguridad similar a finasterida, siendo su eficacia clínica mayor21. Así mismo, Sabal serrulata tiene la capacidad de inhibir las dos isoenzimas de la 5‑α reductasa en tejido prostático humano22, aunque otros estudios han demostrado que la ingesta oral de Sabal serrulata y determinados complementos nutricionales podrían aumentar el número de cabellos en pacientes que padecen AGA23,24.
El objetivo de este estudio es comprobar la eficacia y la seguridad del tratamiento transdérmico de preparados cosméticos estériles ya comercializados y vehiculizados a través de microneedling.
Material y método
El estudio se llevó a cabo siguiendo los principios establecidos en la Declaración de Helsinki, actualizada en 2013. Es un estudio prospectivo sobre la eficacia y seguridad del empleo conjunto de microneedling y la posterior aplicación de preparados tópicos. Se enrolaron 10 pacientes voluntarios varones, diagnosticados previamente de AGA, con una edad promedio de 46 años (rango: 34‑57), con puntuación en la escala de Sinclair 3,9 a 2,06. El periodo de estudio fue de septiembre de 2020 hasta diciembre del mismo año y se llevó a cabo en la Unidad Médica ToskaniMed, Barcelona.
Se consideraron los siguientes criterios de inclusión:
- Diagnóstico de AGA no inferior a 3 años.
- Mayor caída de cabello en los meses de confinamiento, de marzo a mayo de 2020.
- No haber realizado tratamiento alguno para AGA en los 6 meses previos al estudio.
- Ausencia de alergias conocidas.
- PCR y test de antígenos negativos durante el estudio y su desarrollo.
- Aceptar, entender y firmar el consentimiento informado específico.
- Compromiso explícito de realizar el tratamiento domiciliario recomendado.
Material utilizado
Se empleó un dispositivo de microneedling (Neopen® Toskanimed, Equipmed USA LLC, Newport Beach, USA), dotado de un cabezal de 16 agujas macizas de acero de calibre 33G. La tricoscopia, para la obtención de imágenes del cuero cabelludo y del cabello, se realizó mediante el equipo dermatoscópico Handyscope® (FotoFinder Systems GmbH, Bad Birnbach, Alemania).
Las imágenes de tricoscopia obtenidas se analizaron por la empresa independiente TrichoLAB®, especializada en el análisis de imágenes tricológicas, siguiendo el protocolo de medición diseñado por ellos mismos que utiliza como referencia la escala de Sinclair para la evolución de la AGA. De esta forma se evitó la percepción subjetiva de los investigadores.
Las fotografías se realizaron con un equipo de alta resolución de imagen (VisioFace® RD, Courage + Khazaka electronic GmbH, Colonia, Alemania), antes de comenzar el tratamiento y después de realizar la 5ª y 10ª sesión. Para asegurar la reproducibilidad de las imágenes obtenidas del área de estudio, el equipo ofrece la opción de superposición de las imágenes tomadas en la última sesión con las de la sesión actual. Además, consta de un sistema de iluminación homogénea que permite que las tomas fotográficas tengan las mismas condiciones de luminosidad en todas las capturas.
Los productos cosméticos estériles utilizados fueron (Hair Cocktail Plus®, Toskani SL, Barcelona, España) y su composición se detalla seguidamente:
- Vial nº 1 (Hair Cocktail Plus® de 10 ml, Toskani SL, Barcelona, España) compuesto por:
- Sabal serrulata, inhibidor de las dos isoenzimas de la 5αR.
- Cumarina y troxerutina, estimulan la microcirculación favoreciendo la llegada de micronutrientes al folículo y al bulbo piloso.
- Vitaminas B6 y B8, con acción antiseborreica.
- Glutatión, como activador enzimático.
- Pantenol, con acción antiinflamatoria.
- Vial nº 2 (HCPR® de 5 ml, Toskani SL, Barcelona, España) compuesto por:
- Péptidos biomiméticos, prolongan la fase anágena y acortan la telógena.
- bFGF (factor básico de crecimiento de fibroblastos), favorece la microcirculación sanguínea en el cuero cabelludo.
- IGF‑1 (factor de crecimiento insulínico‑1), fortalece el cabello por estimulación de los folículos pilosos.
- VEGF (factor vascular de crecimiento endotelial), favorece la angiogénesis local.
- Minerales (sodio, potasio, magnesio y hierro).
- Aminoácidos y vitaminas A, grupo B, C, E y K, como micronutrientes que estimulan la regeneración y fortalecen el cabello.
- La preparación previa al tratamiento no requirió de anestésicos locales de uso tópico, la desinfección se realizó con digluconato de clorhexidina (Cristalmina® 1%, Laboratorios Salvat, Esplugues de Llobregat, Barcelona).
El protocolo de tratamiento en cada sesión semanal se realizó separando el cabello en líneas longitudinales, deslizando el cabezal del dispositivo 2 veces, en sentido occipito-frontal primero y fronto-occipital después. Las agujas del cabezal se ajustaron a una profundidad de 1 mm y la velocidad de rotación se fijó en 7.200 rpm. No se provocó sangrado, únicamente eritema. En las primeras 6 sesiones de tratamiento se empleó el vial 1, y de las sesiones 7ª a la 10ª se empleó el vial 2. Finalizado cada procedimiento no fue necesario ningún tipo de cuidado posterior, salvo que no se ducharan en las siguientes 8‑10 horas ni se bañaran en playa o piscina. Todos los pacientes pudieron reincorporarse a su actividad cotidiana.
Se realizaron 3 tricoscopias de alta definición, antes del inicio del tratamiento (T0), después de la 5ª sesión (T5), y después de la 10ª sesión (T10), en cada una de las siguientes zonas: área frontal media, 2 cm por detrás de la línea de implantación capilar; área temporal izquierda, 3 cm sobre el pabellón auricular, y en la protuberancia occipital. Las variables objetivas proporcionadas por las tricoscopias fueron evaluadas por el laboratorio independiente TrichoLAB®. Se consideraron las siguientes variables:
- Promedio del número de cabellos por área de control (N/cm²)
- Promedio del espesor del tallo de los cabellos (µm)
- Espesor acumulado del cabello por área de superficie (mm/cm²)
- Escala de Sinclair
El tratamiento domiciliario estaba conformado por:
- Loción tópica (Anti Hair‑loss lotion®, Toskani SL, Barcelona, España). Una aplicación cada noche consistente en 7 vaporizaciones. En su composición intervienen:
- Sabal serrulata.
- Aminexil, con efecto vasodilatador similar al minoxidil y regenerador del colágeno.
- Zinc, estimulador del crecimiento capilar.
- Tratamiento oral (Densihair Boost Capsules®, Toskani SL, Barcelona, España). Se recomendó tomar 2 cápsulas al día, cuya composición es: Sabal serrulata, zinc, selenio, biotina, lisina, cistina y arginina.
Finalizado el tratamiento se realizó una encuesta a todos los voluntarios para conocer su grado de satisfacción.
Análisis estadístico. Los datos se expresaron como media ± desviación estándar. Se realizó un análisis de la normalidad de la muestra mediante el test de Shapiro-Wilk y se aplicó el test no paramétrico de Wilcoxon para comparar los resultados entre todas las áreas de estudio y con el estado basal. Los análisis estadísticos se realizaron utilizando SPSS v.20 (IBM, Madrid, España). Se consideró que un valor de p < 0,05 indicaba significación estadística.
Los datos de satisfacción de los participantes se obtuvieron mediante la realización de encuestas individuales y se expresaron de forma porcentual.
El estudio estadístico del análisis tricológico fue realizado por Tricholab System® basado en la Trichoscopy Derived Sinclair Scale.
Resultados
Todos los pacientes reclutados completaron el estudio. Ningún voluntario mostró efectos adversos durante el tratamiento ni en el postratamiento. Los efectos secundarios fueron los intrínsecos a la técnica de micropunción, siendo etiquetados como leves y transitorios: eritema y molestia leve durante el procedimiento.
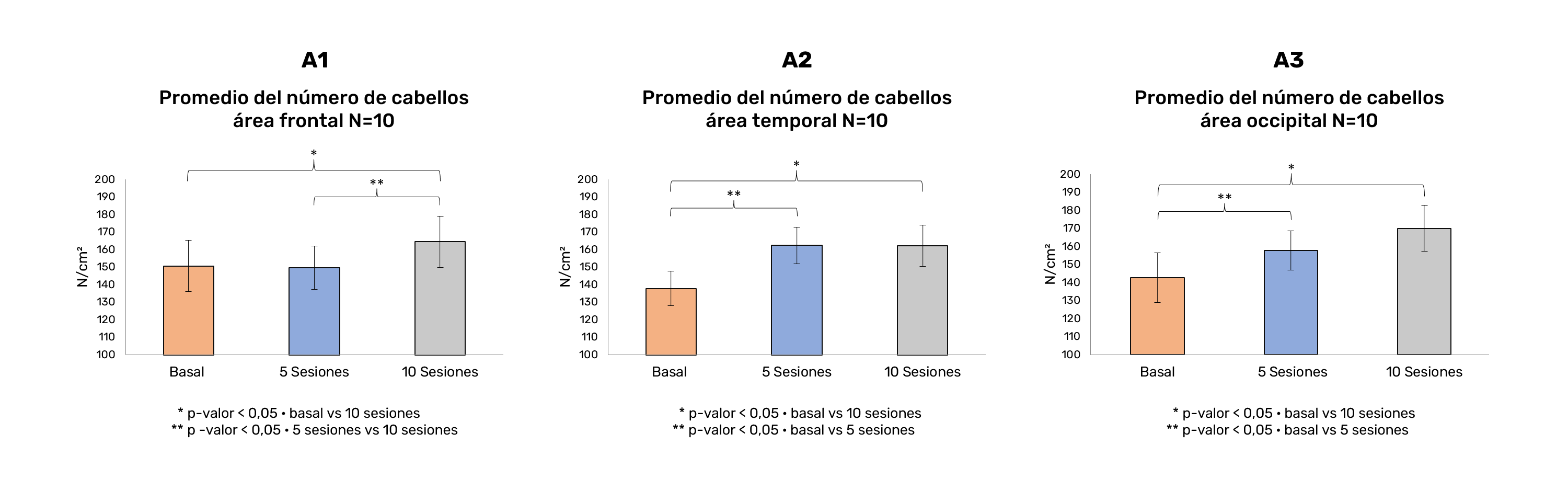
- El número de cabellos por área (N/cm²) se registró en las áreas frontal, temporal y occipital. El mejor resultado se obtuvo en el área occipital con un promedio de 16,9% (p=0,005) respecto de la medición basal. En las áreas frontales y temporales se obtuvieron promedios de mejoría menos significativos, 11,7% (p=0,036) y 8,67% (p=0,047) respectivamente (Figura 1). El grado de mejoría global del total de pacientes fue de un 40%.
- El resultado de la medición del espesor del tallo del cabello, expresado en µm, en las mismas áreas mostró un adelgazamiento en todas las áreas desde la medida inicial basal hasta la practicada después de la 5ª sesión, siendo mayor en el área occipital (3,4%). El grosor del tallo se recuperó en todas las áreas tras la medición posterior a la 10ª sesión: aumentando 0,7% en el área frontal, 4,4% en la temporal y 0,5% en la occipital (Figura 2). El porcentaje global de mejoría de los pacientes, desde la medición basal hasta la obtenida después de la 10ª sesión, fue: 60% en el área frontal, 70% en la temporal y 40% en la occipital.

- En el espesor de cabello acumulado (mm/cm²) se objetivó una mejoría al final del tratamiento de un 6,8% (p=0,048) en el 40% de los pacientes en el área frontal; del 14,7% (p=0,044) en el 70% de los pacientes en la temporal, y del 10,5% (p=0,046) en el 69% en la occipital (Figura 3).

- La evolución de la AGA según la escala de Sinclair, medida con la tecnología de TrichoLAB® comparando el estado basal y después de acabar las 10 sesiones, fue la siguiente:
- En el área frontal, el 30% de los pacientes alcanzó una mejoría significativa, mientras que el 40% no presentó cambios y el 30% restante empeoró ligeramente (estimación de 1,23%). En conjunto, el promedio de mejoría pasó de 2,7 ± 0,2 del estado basal a 2,8 ± 0,1 al acabar el tratamiento.
- En el área temporal, solo el 40% de los pacientes presentó mejoría mientras que el 60% sufrió un empeoramiento respecto del estudio inicial. El promedio del estado basal pasó de 2,7 ± 0,1 a 2,6 ± 0,1 en el estado final.
- En el área occipital, el 60% de los tratados experimentó un grado de mejoría y el 40% tuvo un ligero empeoramiento (estimado en 1,1%). El promedio del estado basal pasó de 2,7 ± 0,2 a 2,7 ± 0,3 en el estado final.
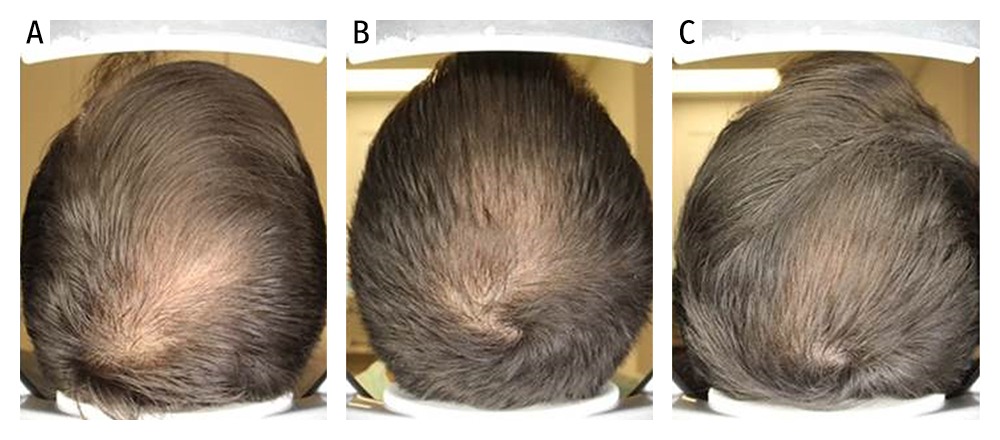
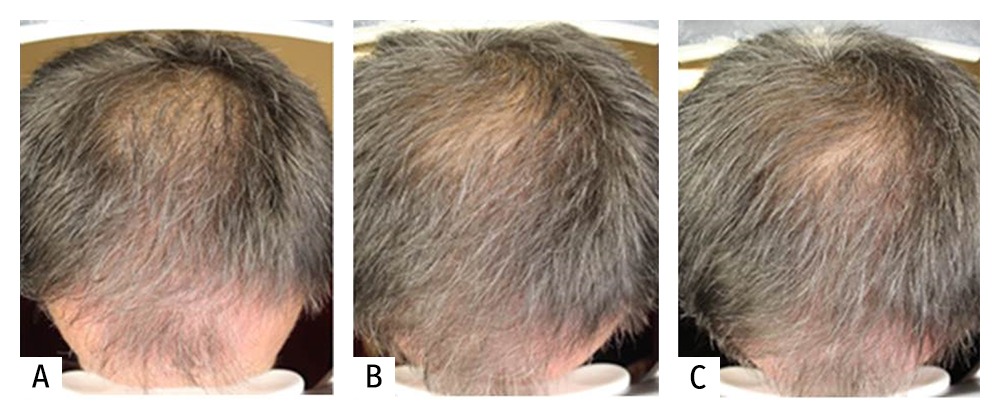
Las Figuras 4, 5 y 6 muestran detalles de los resultados alcanzados, antes de iniciar el tratamiento y tras completar 5 y 10 sesiones, en 3 de los 10 pacientes tratados.

La valoración de los pacientes sobre los resultados alcanzados fueron los siguientes:
- Todos los pacientes se sintieron satisfechos con los resultados obtenidos.
- Respecto a la percepción sobre el efecto anticaída del tratamiento, el 50% de los voluntarios notaron una intensa mejoría; el 40% de los participantes la catalogaron de moderada, y el 10% restante contestaron que fue ligera.
- En cuanto a densidad capilar, el 20% de los encuestados respondieron que habían notado una mejora intensa, el 50% como moderada y, el 30% restante, como ligera.
- Por último, acerca de la aparición de cabello nuevo, el 60% de los participantes notaron una mejora moderada; el 30% detectó una mejora ligera y, el 10% restante, no identificó mejora alguna.
Discusión
La AGA se caracteriza por una reducción progresiva del diámetro, longitud y pigmentación del cabello, tanto en hombres como en mujeres, generando problemas no solo estéticos si no también emocionales3. A pesar de la demanda social existente, en la actualidad solo hay dos fármacos aprobados por la FDA para el tratamiento de la AGA: minoxidil tópico y finasterida25. No obstante, algunos estudios realizados, sobre la combinación de la técnica de microneedling con minoxidil16, han mostrado más efectividad que el empleo aislado de minoxidil, reforzando la hipótesis de que el microneedling favorece la penetración de principios activos al tiempo que potencia la neovascularización26. De otra parte, los tratamientos basados en la inhibición de la acción de la 5‑α reductasa, finasterida y dutasterida, son efectivos en el tratamiento de la AGA, aunque no carecen de efectos adversos controvertidos que limitan o desaconsejan su utilización27.
Por esta razón, se están realizando estudios cuya base de tratamiento son extractos de origen natural, que exhiben propiedades inhibidoras de la 5‑α reductasa, como Sabal serrulata, con potencial para ser efectivos en el tratamiento de la AGA. Entre sus ventajas cuenta que son bien tolerados en humanos, pudiendo administrarse por vía oral, y de forma tópica; en este último caso, con ayuda del microneedling para una mayor eficacia de su absorción y respuesta terapéutica, abriendo así un amplio abanico de posibilidades para el tratamiento de la AGA. Sin olvidar que no solo concurren los factores hormonales a la etiopatogenia de la AGA, también debe tenerse presente la contribución que realizan los factores inflamatorios y oxidativos27.
Para el presente estudio se planteó un protocolo de tratamiento que abordara estas tres vías implicadas en la etiopatogenia de la AGA; utilizando, en primer lugar, la técnica de microneedling para vehiculizar los principios activos contenidos en unos viales cosméticos estériles ya comercializados (Viales nº 1 y nº 2), complementado con una loción tópica y un suplemento alimenticio, que se prescribieron a todos los pacientes, formando parte del protocolo estandarizado para todos los voluntarios.
Teniendo en cuenta que el patrón masculino típico de caída del cabello, con mayor pérdida en ciertas áreas, sobre todo frontal y occipital, los resultados han mostrado una eficacia especialmente llamativa en el área occipital, siendo moderada-ligera en el área frontal, congruentes con la hipótesis de que la combinación de tratamientos a base de Sabal serrulata y péptidos biomiméticos unidos a la acción de la micropunción seriada, que favorece la penetración de estas moléculas al tiempo que mejora la microcirculación de la zona8. Los resultados analizados muestran que se ha frenado la caída del cabello, un aumento en el número de nuevos cabellos con aumento del espesor acumulado28.
También se ha observado un aumento significativo del grosor del tallo capilar, tanto en el área frontal como en la temporal, siendo menor en el área occipital. La disminución del espesor del tallo de los cabellos en esta área se ha interpretado en relación a la aparición de nuevos cabellos en esta área29.
La respuesta no uniforme en las diferentes áreas puede estar condicionada por el corto periodo de seguimiento, que consideramos una de las limitaciones del presente estudio. Por lo tanto, es recomendable acometer nuevos estudios con plazos de seguimiento más prolongados a fin de observar las respuestas tardías al tratamiento y verificar la duración de los resultados obtenidos. Son necesarios controles de seguimiento a largo plazo que, en definitiva, permitirán ajustar mejor la frecuencia de futuras sesiones.
Así mismo, aunque el número de casos incluidos en el estudio es limitado, tanto el resultado alcanzado como el grado de satisfacción expresado por los pacientes mostraron que el tratamiento había complido con las expectativas de los voluntarios en todos los casos. El número de sesiones realizadas es consistente con la eficacia observada en cuanto a disminución de la caída del cabello, la seguridad de los activos y la técnica de microneedling empleada.
Conclusiones
La administración transcutánea de cosméticos estériles para uso tópico, vehiculizados con microneedling, es una técnica prometedora que muestra evidencia de la disminución de la caída y crecimiento de nuevos cabellos.
Los efectos secundarios apreciados durante el tratamiento se limitaron a la aparición de eritema, acompañado de prurito de corta duración en la zona tratada. Por ello, el tratamiento se considera eficaz, seguro y se acompaña de un alto grado de satisfacción por parte de los pacientes.
Conflicto de intereses
El laboratorio ToskaniMed ha facilitado los productos y el uso de sus instalaciones para ejecutar los tratamientos empleados para la realización de este estudio.
Bibliografía
- Camacho Martínez, Francisco Miguel (Editor/a), Tosti, Antonella (Editor/a), Randall, Valerie E. (Coeditor/a), Price, Vera H. (Coeditor/a): Montagna Tricología. Enfermedades del folículo piloso (Tercera Edición). Grupo Aula Médica. 2013.
- Tosti A. Dermoscopy of hair and nail disorders. 2nd ed. CRC Press. Boca Raton, FL. 2015.
- Hunt N, McHale S. The psychological impact of alopecia. BMJ. 2005 Oct 22;331(7522):951‑3. https://doi.org/10.1136/bmj.331.7522.951
- Katzer T, Leite Junior A, Beck R, da Silva C. Physiopathology and current treatments of androgenetic alopecia: Going beyond androgens and anti-androgens. Dermatol Ther. 2019 Sep;32(5):e13059. https://doi.org/10.1111/dth.13059
- Hagenaars SP, Hill WD, Harris SE, Ritchie SJ, Davies G, Liewald DC, Gale CR, Porteous DJ, Deary IJ, Marioni RE. Genetic prediction of male pattern baldness. PLoS Genet. 2017 Feb 14;13(2): e1006594. https://doi.org/10.1371/journal.pgen.1006594
- Gatherwright J, Liu MT, Amirlak B, Gliniak C, Totonchi A, Guyuron B. The contribution of endogenous and exogenous factors to male alopecia: a study of identical twins. Plast Reconstr Surg. 2013 May;131(5):794e‑801e. https://doi.org/10.1097/prs.0b013e3182865ca9
- Rossi A, Anzalone A, Fortuna MC, Caro G, Garelli V, Pranteda G, Carlesimo M. Multi-therapies in androgenetic alopecia: review and clinical experiences. Dermatol Ther. 2016 nov;29(6):424‑432. https://doi.org/10.1111/dth.12390
- Whiting DA. Possible mechanisms of miniaturization during androgenetic alopecia or pattern hair loss. J Am Acad Dermatol. 2001 Sep;45(3 Suppl): S81‑6. https://doi.org/10.1067/mjd.2001.117428
- Varothai S, Bergfeld WF. Androgenetic alopecia: an evidence-based treatment update. Am J Clin Dermatol. 2014 Jul;15(3):217‑30. https://doi.org/10.1007/s40257-014-0077-5
- Kim YS, Jeong KH, Kim JE, Woo YJ, Kim BJ, Kang H. Repeated Microneedle Stimulation Induces Enhanced Hair Growth in a Murine Model. Ann Dermatol. 2016 Oct;28(5):586‑592. https://doi.org/10.5021/ad.2016.28.5.586
- Guarrera M, Rebora A. Kenogen in female androgenetic alopecia. A longitudinal study. Dermatology. 2005;210(1):18‑20. https://doi.org/10.1159/000081477
- Rushton DH, Norris MJ, Van Neste D. Hair regrowth in male and female pattern hair loss does not involve the conversion of vellus hair to terminal hair. Exp Dermatol. 2016 Jun;25(6):482‑4. https://doi.org/10.1111/exd.12945
- Ramos PM, Brianezi G, Martins AC, da Silva MG, Marques ME, Miot HA. Apoptosis in follicles of individuals with female pattern hair loss is associated with perifollicular microinflammation. Int J Cosmet Sci. 2016 Dec;38(6):651‑654. https://doi.org/10.1111/ics.12341
- Kim BJ, Lim YY, Kim HM, et al. Hair follicle regeneration in mice after wounding by microneedle roller. Int J Trichology. 2012;4:117. https://doi.org/10.5021/ad.2016.28.5.586
- Kim HM, Lim YY, An JH, Kim MN, Kim BJ. Transdermal drug delivery using disk microneedle rollers in a hairless rat model. Int J Dermatol. 2012 Jul;51(7):859-63. https://doi.org/10.1111/j.1365-4632.2011.05343.x
- Jha AK, Udayan UK, Roy PK, Amar AKJ, Chaudhary RKP. Original article: Platelet-rich plasma with microneedling in androgenetic alopecia along with dermoscopic pre- and post-treatment evaluation. J Cosmet Dermatol. 2018 Jun;17(3):313‑318. https://doi.org/10.1111/jocd.12394
- Dhurat R, Sukesh M, Avhad G, Dandale A, Pal A, Pund P. A randomized evaluator blinded study of effect of microneedling in androgenetic alopecia: a pilot study. Int J Trichology. 2013 Jan;5(1):6‑11. https://doi.org/10.4103/0974-7753.114700
- Faghihi G, Nabavinejad S, Mokhtari F, Fatemi Naeini F, Iraji F. Microneedling in androgenetic alopecia; comparing two different depths of microneedles. J Cosmet Dermatol. 2021 Apr;20(4):1241‑1247. https://doi.org/10.1111/jocd.13714
- Yang G, Chen G, Gu Z. Transdermal Drug Delivery for Hair Regrowth. Mol Pharm. 2021 Feb 1;18(2):483‑490. https://doi.org/10.1021/acs.molpharmaceut.0c00041
- Willert K, Nusse R. Wnt proteins. Cold Spring Harb Perspect Biol. 2012 Sep 1;4(9):a007864. https://doi.org/10.1101/cshperspect.a007864
- Vañó S. Jaen J. Manual práctico de Tricología. TricoHRC. Madrid. 2019.
- Di Silverio F, Monti S, Sciarra A, Varasano PA, Martini C, Lanzara S, D'Eramo G, Di Nicola S, Toscano V. Effects of long‑term treatment with Serenoa repens (Permixon) on the concentrations and regional distribution of androgens and epidermal growth factor in benign prostatic hyperplasia. Prostate. 1998 Oct 1;37(2):77‑83. https://doi.org/10.1002/(sici)1097-0045(19981001)37:2%3C77::aid-pros3%3E3.0.co;2-i
- Rossi A, Mari E, Scarno M, Garelli V, Maxia C, Scali E, Iorio A, Carlesimo M. Comparitive effectiveness of finasteride vs Serenoa repens in male androgenetic alopecia: a two‑year study. Int J Immunopathol Pharmacol. 2012 Oct‑Dec;25(4):1167‑73. https://doi.org/10.1177/039463201202500435
- Morganti P, Fabrizi G, James B et al. Effect of gelatin-cystine and Serenoa repens extract on free radical levels and hair growth. J. Appl. Cosmetol. 1998; 16: 57‑64.
- Kelly Y, Blanco A, Tosti A. Androgenetic Alopecia: An Update of Treatment Options. Drugs. 2016 Sep;76(14):1349‑64. https://doi.org/10.1007/s40265-016-0629-5
- Shah KB, Shah AN, Solanki RB, Raval RC. A Comparative Study of Microneedling with Platelet-rich Plasma Plus Topical Minoxidil (5%) and Topical Minoxidil (5%) Alone in Androgenetic Alopecia. Int J Trichology. 2017 Jan‑Mar;9(1):14‑18. https://doi.org/10.4103/ijt.ijt_75_16
- Andriole GL, Kirby R. Safety and tolerability of the dual 5alpha-reductase inhibitor dutasteride in the treatment of benign prostatic hyperplasia. Eur Urol. 2003 Jul;44(1):82‑8. https://doi.org/10.1016/s0302-2838(03)00198-2
- Guerra A, Gonzalez-Guerra, Borrás JM. Alopecia androgénica femenina. Nuevas herramientas terapéuticas frente a los factores fisiopatológicos implicados: hormonal, oxidativo e inflamatorio. Más Dermatología. 2017;27:21‑33.
- Kasprzak M, Sicińska J, Sinclair R. The Trichoscopy Derived Sinclair Scale: Enhancing visual assessment through quantitative trichoscopy. Australas J Dermatol. 2019 May;60(2):134‑136. https://doi.org/10.1111/ajd.12964



