Revisión comparativa de toxinas botulínicas tipo A de uso en medicina estética comercializadas en España
for use in aesthetic medicine marketed in Spain
Introducción
La toxina botulínica (TB) es una neurotoxina producida por la bacteria Clostridium botulinum1, la cual elabora diferentes serotipos de TB que pueden ser distinguidos antigénicamente (A, B, C, D, E…)2. Recientes investigaciones han descubierto nuevos subtipos de TB‑A (TB‑A1, TB‑A2…, TB‑B1, TB‑B2…)3. Sin embargo, la importancia biológica de estos nuevos sub-serotipos no ha sido aún elucidada4. Todos los serotipos de TB‑A muestran una arquitectura molecular similar, están compuestos por dos cadenas polipeptídicas, una cadena pesada de aproximadamente 100 kD y una cadena ligera de 50 kD, ambas unidas por un enlace disulfuro. Este complejo de TB está asociado a otras proteínas que, también, pueden tener propiedades hemaglutinantes5. En cuanto al mecanismo de acción, todos los serotipos interfieren con la transmisión neuromuscular mediante el bloqueo de la liberación de acetilcolina. Específicamente, la TB‑A ejerce su acción interfiriendo con la función de la proteína SNAP 25, cuyo papel principal es facilitar la fusión de las vesículas de acetilcolina con la membrana celular para su liberación al espacio intersináptico a fin de realizar la consiguiente transmisión neuromuscular5‑7. En la actualidad, la inyección con TB‑A es uno de los tratamientos estéticos faciales más demandados en todo el mundo. De acuerdo con la Sociedad Internacional de Cirugía Plástica Estética (ISAPS) más de 4,9 millones de procedimientos con TB se notificaron en 20166. Este procedimiento estético ha sido también el más utilizado en los últimos años en Estados Unidos. De acuerdo con la Sociedad Americana de Cirugía Plástica y Estética (ASAPS), en 2016 fueron registrados más de 4,5 millones de procedimientos estéticos con TB‑A, a los que se suman más de 1,5 millones en 20177. En España, así como en el resto del mundo, la inyección con TB es el procedimiento estético no quirúrgico más realizado, con más de 81.000 notificaciones en 2016, según la ISAPS9.
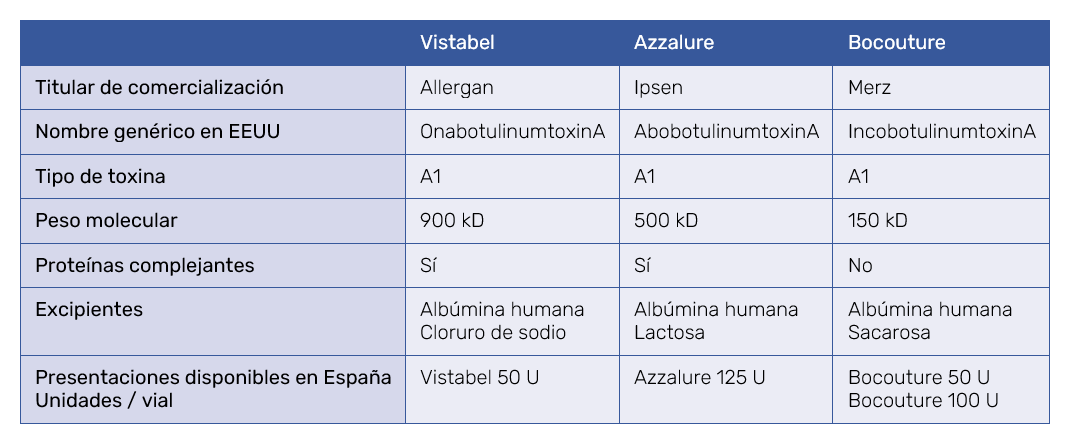
Actualmente, en España coexisten en el mercado diferentes marcas de TB‑A para su uso en ME que son por orden alfabético Azzalure® (Ipsen Pharma, S.A. España)8 Bocouture® (Merz Pharma España S.L.)9,10 y Vistabel® (Allergan Pharmaceuticals Ireland)11. A pesar de que todos los productos contienen el mismo principio activo (TB‑A), éstos no son intercambiables entre sí y la información de sus respectivas fichas técnicas (FT) son diferentes. La Tabla I muestra las principales características de cada una de ellas.
Las TB‑A usadas en Medicina Estética (ME) deberían tener similares indicaciones, posologías y perfil de seguridad. No obstante, existen discrepancias en las indicaciones, posología y en los apartados de seguridad de las FT de estos productos. El objetivo de este trabajo es realizar un análisis comparativo de las TB‑A de uso exclusivo en ME comercializadas en España e identificar las peculiaridades, similitudes y diferencias de las mismas. Además, se analizará el motivo de estas diferencias, y si éstas son relevantes desde el punto de vista de la seguridad de su uso en el paciente.
Material y método
Se realizó una última búsqueda, julio de 2018, en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) con el término “toxina botulínica”. De todas las FT obtenidas, se seleccionaron solo aquellas que contenían TB‑A autorizados para su uso médico-estético. Se realizó un análisis comparativo evaluando las similitudes, diferencias y peculiaridades de cada una de ellas, con principal énfasis en el perfil de seguridad de las mismas. Cabe tener en cuenta que las recomendaciones o advertencias referidas a sus posibles efectos adversos, cuando son del mismo grado de severidad y presentación clínica, deben ser consideradas similares, aunque el término empleado en las FT no sea exactamente el mismo. Ejemplo: reacción alérgica se consideró similar a reacción de hipersensibilidad pero diferente a shock anafiláctico; disnea se consideró similar a dificultad para respirar pero diferente a broncoespasmo o insuficiencia respiratoria.
Resultados
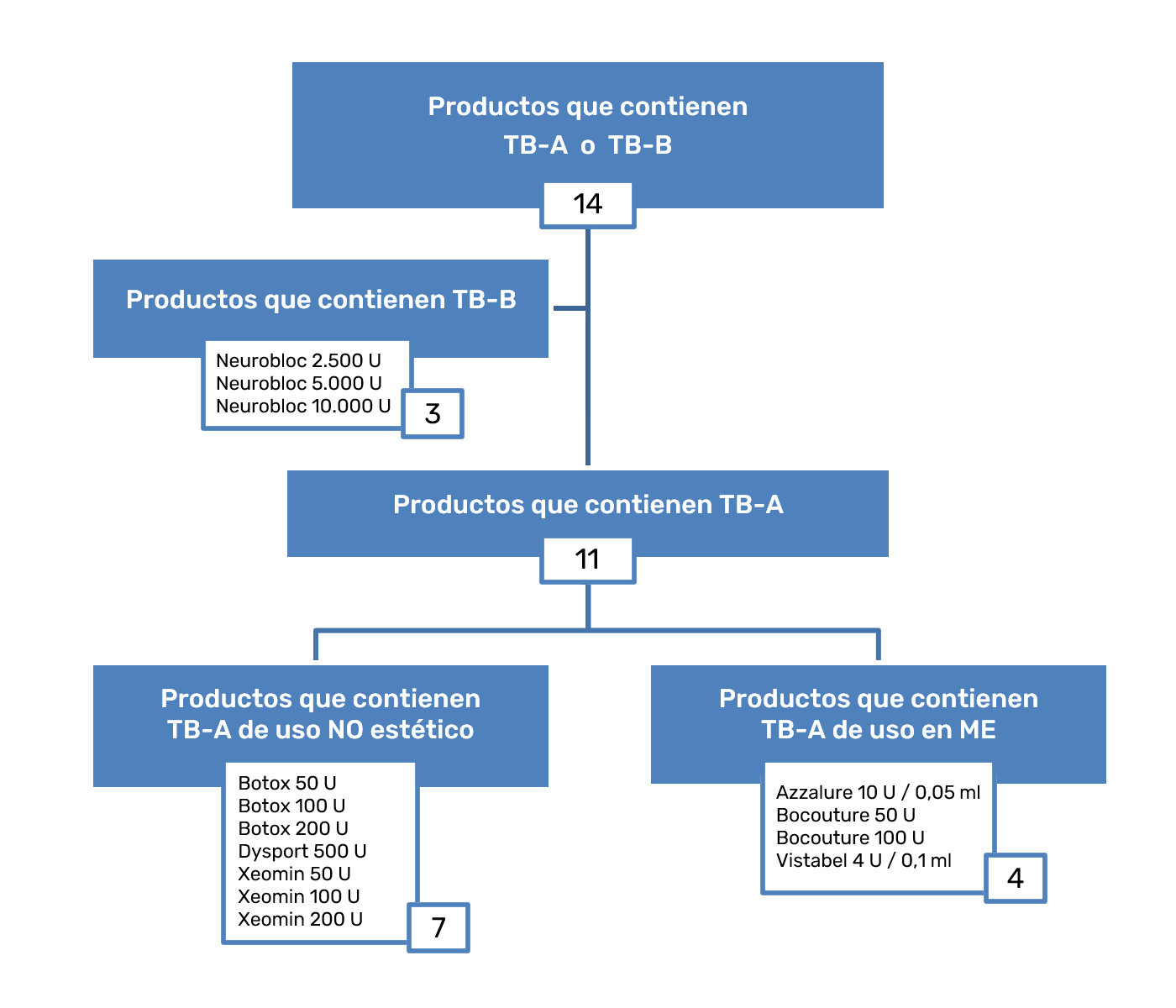
Se identificaron 14 FT diferentes de productos con TB; de éstas, once corresponden a productos con TB‑A y tres a TB‑B. De las 11 FT de productos que contienen TB‑A, solo 4 están autorizadas para su uso en ME; por orden alfabético son: Azzalure 10 U Speywood / 0,05 ml8, Bocouture 50 U9, Bocouture 100 U10 y Vistabel 4 U / 0,1 ml11. Las restantes 7 FT que contienen TB‑A son productos autorizados para otras indicaciones terapéuticas no médico-estéticas (Figura 1).
Para la revisión y comparación de este trabajo, se seleccionaron las FT más actualizadas disponibles de Azzalure (noviembre 2017), Bocouture (enero 2018) y Vistabel 4 U (diciembre de 2017).
Es una revisión comparativa entre FT que contienen TB‑A de uso en ME en España. Las FT revisadas están alineadas y siguen el formato actual recomendado por las guías Europeas de la Agencia Europea del Medicamento12.
Composición cualitativa y cuantitativa
Todas las FT especifican la cantidad total de unidades de TB‑A por cada vial. Azzalure indica que cada vial contiene 125 U Speywood, Vistabel 50 U Botox y Bocouture 50 U o 100 U DL 50 por vial, según cada presentación. Respecto a su composición cualitativa, Azzalure contiene TB‑A de C. botulinum-complejo hemaglutinina. Bocouture indica que su TB‑A es de 150 kD y libre de proteínas complejantes (purificada de cultivos de C. botulinum, Cepa Hall). Vistabel en cambio, no da detalles sobre este tema en su FT. No hay diferencias en la presentación de su forma farmacéutica; Azzalure, Bocouture y Vistabel se comercializan como polvo blanco para solución inyectable.
Indicaciones terapéuticas
Los 3 productos están indicados en adultos para la mejoría temporal del aspecto de líneas faciales de intensidad moderada a grave, cuando las líneas glabelares y/o las líneas del canto lateral son visibles en máximo fruncimiento y/o sonrisa y, también, cuando la severidad de estas líneas tiene un impacto psicológico negativo importante en el paciente. Además, Bocouture y Vistabel tienen la indicación para la mejoría temporal en el aspecto de líneas frontales horizontales, moderadas a graves, producidas en máxima elevación de las cejas. Azzalure y Bocouture restringen su indicación a pacientes adultos pero menores de 65 años.
Posología y forma de administración

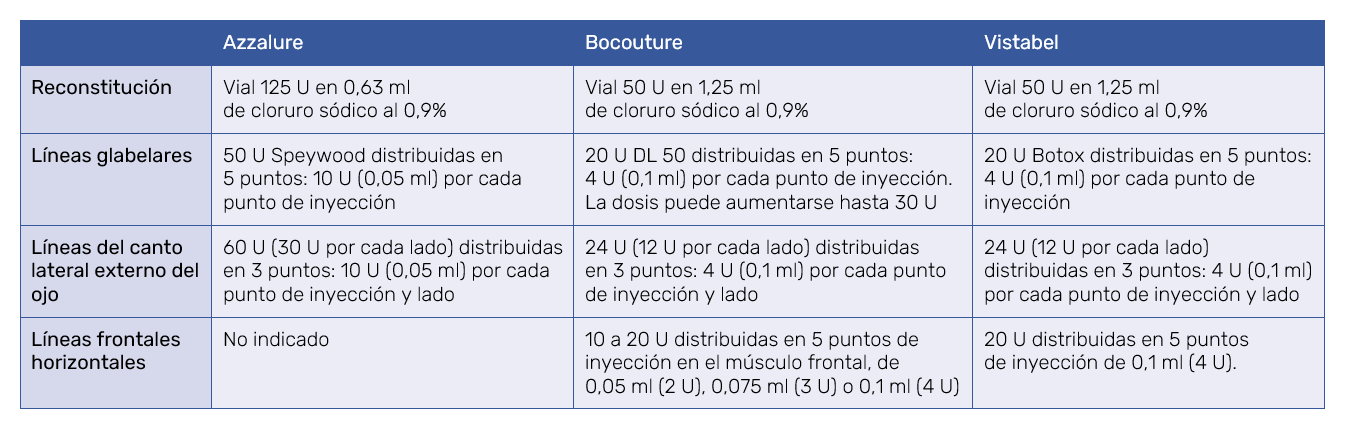
Todas las FT describen con gráficos y por escrito, los puntos anatómicos de referencia donde administrar el producto reconstituido. Además, especifican las dosis recomendadas en unidades de TB‑A en relación al volumen (expresado en ml) en cada inyección. Los gráficos y esquemas anatómicos, aunque parecidos, no son idénticos entre los 3 productos. Las FT de los 3 productos tienen especificaciones en común, y se resumen en la Tabla II.
La principal diferencia en este apartado son las dosis de unidades recomendadas de TB‑A por volumen (ml) de solución reconstituida, así como la falta de instrucciones de uso en líneas frontales horizontales en la FT de Azzalure, ya que no tiene autorizada esta indicación. La Tabla III recoge dichas diferencias.
Contraindicaciones
Las 3 toxinas presentan similares contraindicaciones de uso:
- Hipersensibilidad al principio activo o a alguno de los excipientes.
- Presencia de infección en los puntos en que se pretende inyectar.
- Pacientes con trastornos generalizados de la actividad muscular, como miastenia grave o Síndrome de Eaton-Lambert.
Las discrepancias en este apartado son mínimas, Azzalure contraindica su uso en pacientes con esclerosis lateral amiotrófica, y Bocouture cuando hay inflamación en la zona a inyectar. Estas contraindicaciones adicionales, son advertidas en las FT de los otros productos en el siguiente apartado de precauciones de uso.
Advertencias y precauciones especiales de uso

Las advertencias y precauciones de uso comunes a las 3 toxinas se resumen en la Tabla IV.
Bocouture y Azzalure recomiendan precaución de uso en pacientes tratados con anticoagulantes o con tiempo de hemorragia prolongado, Vistabel no indica precaución alguna en esta población. Sin embargo, en la FT de Vistabel se detallan las potenciales reacciones de anafilaxia y la recomendación de disponer de epinefrina en el consultorio, así como reacciones que se relacionan con el modo de administración (cuadros vasovagales o síncopes relacionados con el dolor o la ansiedad por la inyección), y efectos de TB‑A a distancia (disfagia, debilidad muscular o disnea). Bocouture solo advierte de algunos de estos posibles riesgos, como hipersensibilidad y cuadros vasovagales. Azzalure no menciona ninguno de los anteriores.
Asimismo, Bocouture especifica que las 4‑aminoquinolinas pueden reducir su efecto al interferir con la transmisión neuromuscular. También, Bocouture es la única que contempla su uso durante el embarazo, siempre que sea claramente necesario y cuando el beneficio potencial supere al riesgo. Bocouture y Vistabel no están recomendados durante la lactancia, Azzalure solo especifica que no se puede recomendar su uso durante la lactancia.
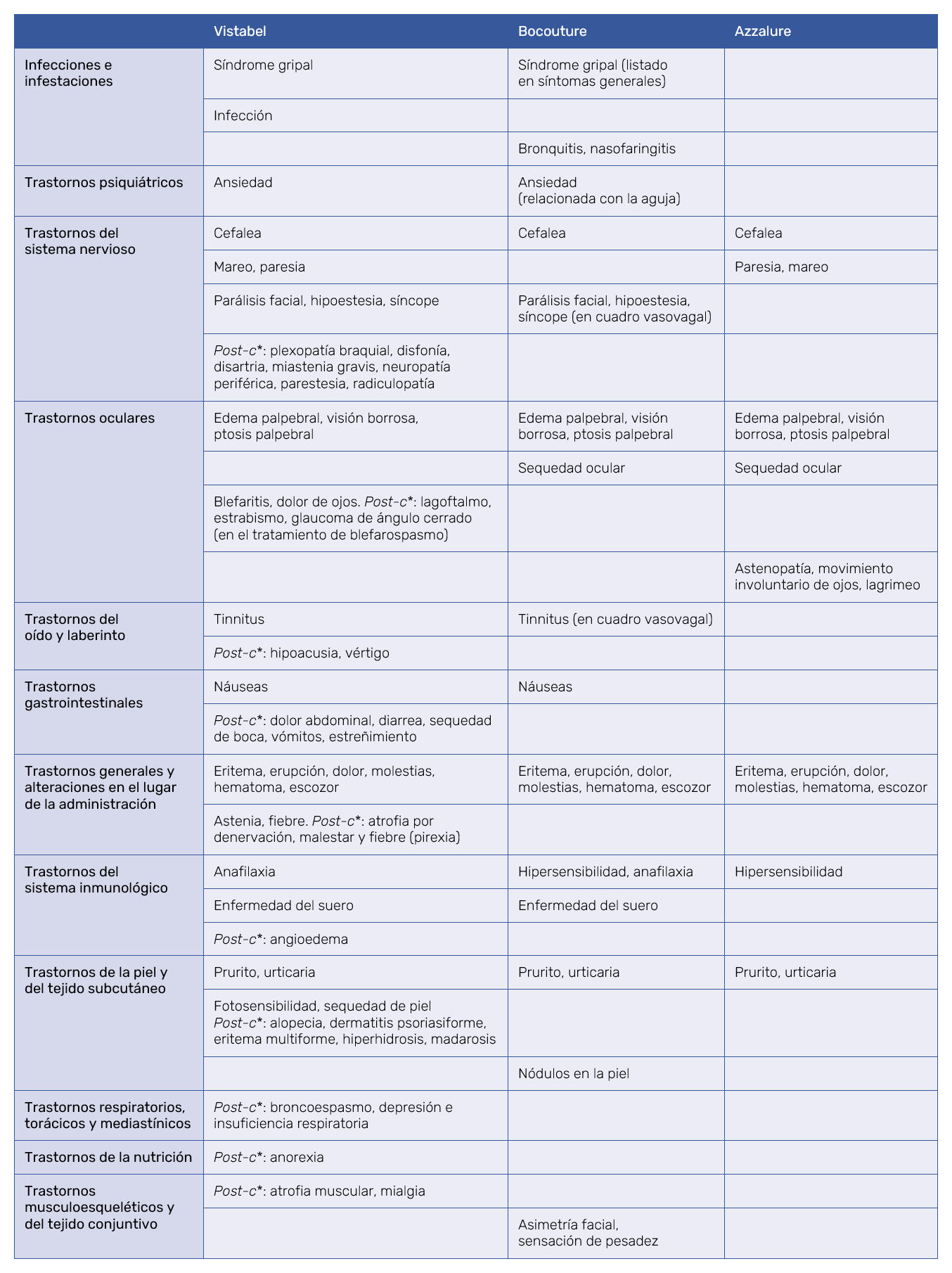
Reacciones adversas
Dentro de las similitudes de este apartado, las FT de los 3 productos reflejan que las reacciones adversas (RA) pueden estar relacionadas con la sustancia activa, con el procedimiento de inyección o con ambos. Además, todas especifican que las RA suelen aparecer en los primeros días después de la inyección y son en su mayoría transitorias. Las 3 FT especifican que raramente se han comunicado efectos de la TB‑A en zonas alejadas del lugar de inyección, como debilidad muscular excesiva, disfagia, o neumonía por aspiración, con consecuencias fatales en algún caso.
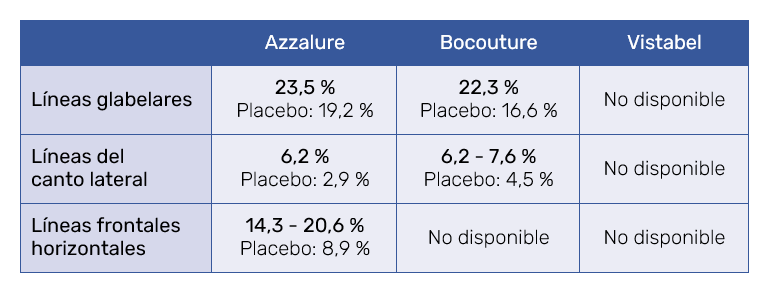
Entre las diferencias de FT, destaca que Bocouture hace una introducción en la que explica y subdivide las reacciones en cuatro subgrupos: 1) Reacciones adversas relacionadas a la aplicación, 2) Reacciones adversas relacionadas con la clase de sustancia, TB‑A, 3) Diseminación de la toxina, y 4) Reacciones de hipersensibilidad. En cambio, Vistabel y Azzalure introducen el porcentaje de la incidencia general de RA observadas en estudios clínicos controlados en comparación frente a placebo. Por el contrario, Bocouture solo describe los posibles efectos adversos sin cuantificar. Lo que se resume en la Tabla V.
Las 3 FT presentan las RA, observadas en estudios clínicos, separadas por cada indicación. Vistabel además presenta una tabla adicional con RA notificadas después de la comercialización del producto. La Tabla VI contiene todas las RA listadas en las FT de los tres productos, independientemente de la indicación. Las RA observadas en más de una indicación solo se reflejan una vez.
Sobredosis
En cualquiera de las 3 TB‑A, la sobredosis estaría relacionada con el efecto farmacológico a distancia, y se manifestaría como debilidad o parálisis neuromuscular. Los síntomas que pueden aparecer son: debilidad general, ptosis, diplopía, dificultades para respirar, dificultades en el habla, parálisis de los músculos respiratorios o dificultades en la deglución y neumonía por aspiración. Las medidas a tomar en casos de sobredosis son comunes a las 3 toxinas; en todas se aconseja supervisión médica y tratamiento sintomático, además de considerar hospitalización y medidas de apoyo respiratorio en pacientes con síntomas de intoxicación por TB‑A.
Propiedades farmacológicas
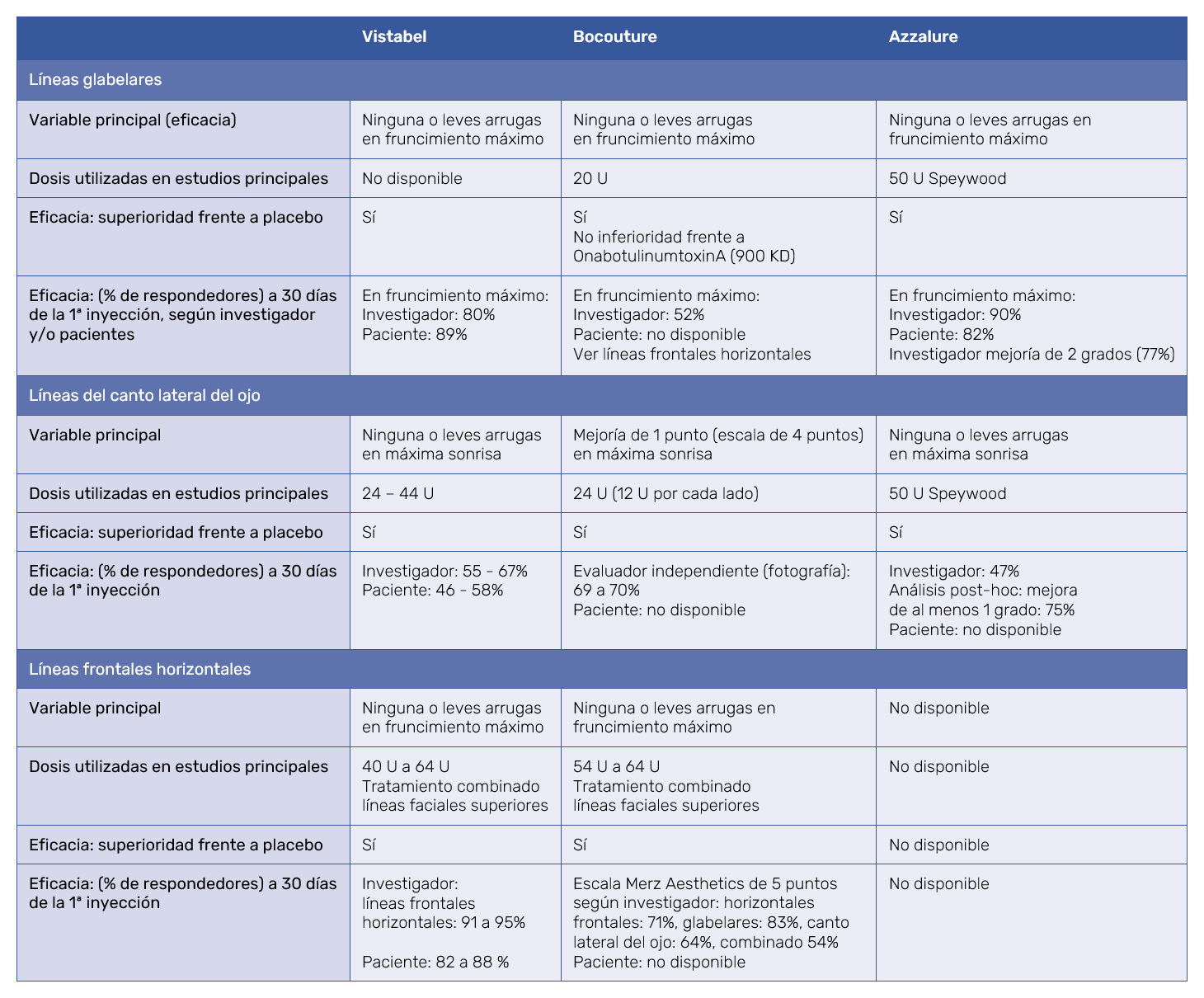
Los tres productos están clasificados como relajantes musculares de acción periférica; con código ATC: M03AX01. Los datos en ensayos clínicos son también explicados brevemente en esta sección de la FT. Todas las toxinas presentan datos de ensayos clínicos en más de 1000 sujetos, demostrando superioridad frente a placebo en todas sus indicaciones. La Tabla VII resume y compara los datos presentados por los 3 productos.
Propiedades farmacocinéticas
No se han realizado estudios farmacocinéticos (absorción, distribución, biotransformación y eliminación) con ninguna TB‑A en seres humanos. Vistabel describe que estudios realizados en ratas muestran que, tras su inyección, el complejo marcado 125I-TB-A se reduce hasta la mitad en unas 10 horas. A 24 horas post-inyección, el 60% de la radioactividad se excreta por orina. Bocouture explica que la TB‑A sufre un transporte axonal retrógrado después de la inyección i.m. Sin embargo, no se ha encontrado el pasaje trans-sináptico retrógrado de la TB‑A en el sistema nervioso central. Las moléculas de TB‑A que circulan libres se degradan como cualquier otra proteína.
Datos preclínicos de seguridad
Se reflejan de manera diferente en las FT de estos productos, lo que hace difícil una comparación directa entre ellas. Todos los productos fueron estudiados al menos en dos especies (ratas y conejos), y se puede inferir (no asegurar) que no hay riesgo de embriotoxicidad a las dosis recomendadas en humanos.
Datos farmacéuticos
Los 3 productos contienen albúmina humana; se diferencian en que Vistabel además contiene cloruro sódico, Bocouture sacarosa y Azzalure lactosa. También se indica que no deben mezclarse con otros fármacos.
El producto reconstituido debe utilizarse inmediatamente; aunque se ha demostrado estabilidad química y física durante 24 h a temperaturas entre 2° C a 8° C. Una diferencia en cuanto a la conservación es que mientras que Vistabel y Azzalure se deben conservar en nevera (2° C a 8° C), Bocouture puede conservarse a temperatura no superior a 25° C.
Discusión
Las 3 TB‑A de uso en ME comercializadas en España tienen similar forma farmacéutica, polvo blanco para reconstituir con cloruro de sodio al 0,9% y obtener una solución inyectable. La única vía de administración recomendada es i.m., con un intervalo entre dosis no inferior a 3 meses. Todas comparten contraindicaciones de uso lógicas, como no inyectar TB‑A en pacientes con hipersensibilidad al principio activo o a sus excipientes, si hay infección en los puntos de inyección y en pacientes con trastornos generalizados de la actividad muscular. Todas advierten sobre el potencial riesgo de diseminación local y a distancia, precaución en pacientes con trastornos neuromusculares preexistentes. También recomiendan no administrar estos productos a pacientes con disfagia y/o en riesgo de aspiración y no inyectar en un vaso sanguíneo. Todas coinciden en el potencial riesgo que poseen sobre la capacidad de conducir y usar máquinas debido a la astenia, debilidad muscular y trastornos visuales que potencialmente puedan ocurrir. Con ninguna TB‑A se han realizado estudios de interacciones, pero todas advierten que el efecto de la TB‑A se puede ver potenciado por medicamentos que interfieren con la transmisión neuromuscular. Dichas recomendaciones son lógicas y razonables si se considera la potencial sinergia farmacodinámica que ocurre con la administración concomitante de estos fármacos.
Dentro de la falta de datos clínicos con las TB‑A de uso en ME también hay que destacar que ninguna posee estudios en sujetos menores de 18 años, ni se han realizado estudios farmacocinéticos, se carece de datos suficientes en mujeres embarazadas, se desconoce si se excreta por leche materna, y no existen datos de fertilidad en humanos.
Sin embargo, difieren en la composición cuantitativa y cualitativa; Azzalure contiene 125 U Speywood por vial, mientras que Bocouture y Vistabel emplean viales de 50 U, y 50 U o 100 U, respectivamente. Bocouture especifica que su molécula tiene un peso molecular de 150 kD, libre de proteínas complejantes, mientras que en Azzalure y Vistabel la TB‑A está asociada a proteínas del complejo hemaglutinina y no hemaglutinina. En base a publicaciones existentes13,14 el peso molecular de OnabotulintoxinA (Vistabel) es de 900 kD, y el de Azzalure de 500 kD; así que estas moléculas no se consideran intercambiables. A pesar de las diferencias moleculares, no se observan diferencias en el perfil de seguridad o tolerancia local. Las diferencias en cuanto a posología son debidas básicamente a que la reconstitución de unidades por volumen (U/ml) es específica para cada producto y a que las respectivas moléculas de TB‑A no son iguales13. Bocouture y Vistabel tienen autorizada la indicación para mejora de líneas frontales horizontales (aunque no Azzalure). Esta indicación adicional es debida a que estas compañías han realizado estudios en el tratamiento combinado de las líneas faciales superiores (incluidas líneas frontales horizontales), demostrando ambas clara superioridad frente a placebo. Azzalure y Bocouture restringen su indicación a pacientes menores de 65 años; Vistabel no lo hace, aunque especifica que tiene datos limitados en esta población y que su eficacia es menor. Esta eficacia menor podría ser explicada, no por falta de efecto de la TB‑A en estos sujetos, sino deberse al tipo de arrugas comúnmente observadas en esta población, combinación de arrugas dinámicas, junto a las causadas por la pérdida de elasticidad cutánea15, rotura cutánea (dermo-epidérmica), gesticulación excesiva y por el proceso natural de envejecimiento cutáneo sumado a los cambios anatómicos asociados a la edad16. Dentro de las advertencias, Vistabel no indica precaución al emplearse en pacientes con tratamiento anticoagulantes o problemas de coagulación. Las advertencias y precauciones más relevantes de uso de los 3 productos constan en las FT. No existen diferencias importantes en este apartado entre las FT, más allá de su forma de redacción y la agrupación de los posibles riesgos. Solo Bocouture deja abierto su uso durante el embarazo en caso de que sea claramente necesario y que el beneficio potencial supere al riesgo. Esta recomendación sorprende, ya que no existen datos en embarazadas, y en el mismo apartado de la FT se expresa que los estudios en animales han mostrado toxicidad reproductiva. Además, difícilmente el uso de esta sustancia se prevé estrictamente necesario durante el embarazo.
Dentro de las RA, éstas pueden relacionarse con el efecto farmacológico de la TB‑A, procedimiento de inyección o ambos; en su mayoría, las RA son transitorias y ocurren en los primeros días o semanas después de la administración del fármaco. Las RA comunes a todas las FT son trastornos oculares (edema palpebral, visión borrosa, ptosis palpebral), seguidas de reacciones locales en el sitio de aplicación: eritema, erupción, dolor, molestias, hematoma, escozor, prurito, y urticaria. También se han descrito RA generales: cefalea, anafilaxia o hipersensibilidad. La incidencia de RA observada fue mayor cuando se trataron líneas glabelares, en comparación a las líneas del canto lateral del ojo; lo que podría relacionarse porque se requieren mayores dosis para tratar esta zona. Vistabel es el producto que tiene mayor número de RA registradas en órganos y sistemas. En este apartado, sorprende que Azzalure no informe de ninguna RA sobre el sistema músculo-esquelético, siendo la TB‑A una sustancia que ejerce su acción directamente sobre la unión neuromuscular; aunque podría deberse a que el criterio usado para incluir reacciones en esta sección no fuera el mismo para los tres productos. Estos criterios, aunque siguen guías específicas12 y unos parámetros generales, como son las frecuencias de RA observadas en ensayos clínicos, las diferencias frente a placebo y la valoración médica de relación de causalidad; los criterios finales utilizados para incluir o no cada RA los decide cada compañía. El listado final de RA se revisa y debe aprobarse por la autoridad sanitaria competente de cada país o región, lo cual no siempre es idéntico. Otra explicación podría ser a que la OnabotulinumtoxinA (Vistabel y Botox) es el producto que lleva mayor tiempo en el mercado, está comercializado en muchos países, y tiene mayor número de indicaciones aprobadas; por tanto, se presume que tiene más población expuesta y, en consecuencia, la mayoría de RA post comercialización se refieren solo en Vistabel (Tabla IV). Podría explicarse porque existe un número indeterminado de sujetos expuestos a TB‑A en indicaciones no aprobadas (off‑label use); también podrían estar sesgados los datos al incluir indicaciones aprobadas para Botox, ya que las dosis son mayores y los sitios de aplicación diferentes, dentro de estas se puede mencionar a modo de ejemplo el glaucoma de ángulo estrecho en tratamiento de blefarospasmo. Esta observación es consistente con lo que ocurre habitualmente en la vida de los fármacos, las RA raras (de baja incidencia) y las graves son generalmente detectadas u observadas en el período post comercialización cuando miles de pacientes son expuestos al producto; una revisión reciente17 avala estos datos. En las RA referidas en 2 de las 3 FT, las diferencias son sutiles; habría que distinguir las RA debidas al efecto farmacológico (parestesia, parálisis facial, sequedad ocular), de las que resultan por el modo de aplicación (ansiedad, síncope o tinnitus relacionados a cuadro vasovagal por temor a la aguja). Otras RA, frecuentes en la población general, como síndrome gripal o nasofaringitis, podrían deberse a otras causas, pero son referidas por la dificultad para desvincularlas del posible efecto del fármaco. La falta de mención de alguna de estas RA en una de las tres FT no supone preocupación de seguridad, ya que se refieren en otras secciones de la FT o bien han sido descritas en publicaciones recientes. Por ejemplo, en revisiones sistemáticas sobre AbobotulinumtoxinA18 (Azzalure) se describen RA de tipo general como nasofaringitis, sinusitis o gripe y en el caso de IncobotulintoxinA19 (Bocouture) se ha descrito constipación. Cabe señalar que en el análisis global de RA en las FT y las descritas en revisiones recientes, no suponen una tendencia desfavorable en el perfil de seguridad.
Los datos de eficacia de ensayos clínicos descritos en las FT demostraron una clara superioridad frente a placebo. Sin embargo, comparar la eficacia entre estos productos es difícil, ya que el porcentaje de respondedores fue medido sobre las mismas variables (por ejemplo: ninguna o leves arrugas en máximo fruncimiento o máxima sonrisa), y las escalas utilizadas para considerar respondedor o no respondedor, no fueron uniformes entre los productos. Entre estas valoraciones se incluyeron las siguientes: interpretación del investigador, interpretación del paciente, evaluador independiente por terceros con fotografías, mejoría de 1 punto en escalas de 4 puntos o en escalas de 5 puntos, incluso se hicieron análisis adicionales de mejoría sobre estas escalas. Por ello resulta difícil hacer una comparación directa de eficacia entre las mismas y hacerlo puede llevar a errores de interpretación. No obstante, revisiones sistemáticas recientes concluyen que la eficacia entre las TB‑A de uso en ME es comparable20.
De los datos pre-clínicos de seguridad, descritos en las FT, solo se puede intuir (pero no asegurar) que utilizando estos productos a dosis recomendadas en humanos en ME, no habría riesgo de embriotoxicidad ni de teratogenicidad.
Las 3 TB‑A contienen albúmina humana en su composición, pero se diferencian en que Vistabel añade cloruro sódico, Bocouture sacarosa y Azzalure lactosa. Finalmente, Vistabel y Azzalure se deben conservar en nevera (entre 2° C a 8° C), mientras que Bocouture puede conservarse a temperatura no superior a 25° C. Estas diferencias de composición y conservación no presuponen problemas seguridad para los pacientes.
Conclusiones
Las TB‑A de uso en ME comercializadas en España pueden considerarse productos seguros si son utilizadas siguiendo las recomendaciones de sus FT. Debido a las diferencias moleculares, modo de reconstitución y dosis, no son intercambiables. Las indicaciones aprobadas están relacionadas con los estudios clínicos realizados por cada compañía. Todas tienen riesgo de diseminación local y denervación química de músculos contiguos no tratados. El riesgo de diseminación a distancia es descrito como poco frecuente cuando estos fármacos se utilizan a dosis recomendadas. Las diferencias en número y presentaciones de RA estarían relacionadas a la cuantía de población expuesta y a los criterios utilizados por cada compañía para denominarlos y/o incluirlos en la sección de RA. Los riesgos son predecibles y relacionados con el mecanismo de acción de la TB‑A o el modo de administración, por inyección i.m. A pesar de las diferencias observadas en el listado y número de RA entre los productos, no se ha identificado ninguna tendencia desfavorable en cuanto al tipo y severidad de RA, ni en el perfil de seguridad entre las TB‑A de uso en ME.
Conflicto de intereses
No hay ninguno.
Bibliografía
- Schantz EJ, Johnson EA. Properties and use of botulinum toxin and other microbial neurotoxins in medicine. Microbiol Rev 1992 Mar;56(1):80‑99. https://doi.org/10.1128/mr.56.1.80-99.1992
- Smith TJ, Hill KK, Raphael BH. Historical and current perspectives on Clostridium botulinum diversity. Res Microbiol 2015;166(4):290‑302. https://doi.org/10.1016/j.resmic.2014.09.007
- Peck MW, Smith TJ, Anniballi F, Austin, J. W., Bano, L., Bradshaw, M. et al. Historical Perspectives and Guidelines for Botulinum Neurotoxin Subtype Nomenclature. Toxins 2017;9(1):38. https://doi.org/10.3390/toxins9010038
- Pirazzini M, Rossetto O, Eleopra R, Montecucco C, et al. Botulinum Neurotoxins: Biology, Pharmacology, and Toxicology. Pharmacol Rev 2017;69:200‑235. https://doi.org/10.1124/pr.116.012658
- Münchau A, Bhatia KP. Uses of botulinum toxin injection in medicine today. BMJ 2000;320:161‑165. https://doi.org/10.1136/bmj.320.7228.161
- Sociedad Internacional de Cirugía Plástica Estética (ISAPS).
- ASAPS American Society for Aesthetic Plastic Surgery. Disponible en: https://www.surgery.org/media/statistics
- AZZALURE 10 UNIDADES SPEYWOOD/0,05 ml. Ficha técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de información de Medicamentos AEMPS (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/ft/71300/FT_71300.html
- BOCOUTURE 50 UNIDADES. Ficha técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de información de Medicamentos AEMPS (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/ft/72709/FT_72709.html
- BOCOUTURE 100 UNIDADES. Ficha técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de información de Medicamentos AEMPS (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/ft/81177/FT_81177.html
- VISTABEL 4 UNIDADES ALLERGAN/0,1 ml. Ficha técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de información de Medicamentos AEMPS (CIMA). Disponible en: https://cima.aemps.es/cima/dochtml/ft/65837/FT_65837.html
- A Guideline on Summary of Product Characteristics (SmPC). September 2009. Revision 2. Disponible en: https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-2/c/smpc_guideline_rev2_en.pdf
- Brin MF, James C, Maltman J et al. Botulinum toxin type A products are not interchangeable: a review of the evidence. Biologics 2014;8:227‑41. https://doi.org/10.2147/btt.s65603
- Frevert J. Content of Botulinum Neurotoxin in Botox®/Vistabel®, Dysport®/Azzalure®, and Xeomin®/Bocouture®. Drugs R D 2010;10(2):67‑73. https://doi.org/10.2165/11584780-000000000-00000
- Sundaram H, Signorini M, Liew S, Trindade de Almeida AR, Wu Y, Vieira Braz A, et al. Global Aesthetics Consensus: Botulinum Toxin Type A--Evidence-Based Review, Emerging Concepts, and Consensus Recommendations for Aesthetic Use, Including Updates on Complications. Plast Reconstr Surg 2016;137(3):518e‑529e. https://doi.org/10.1097/01.prs.0000475758.63709.23
- Bryan Mendelson, Chin-Ho Wong. Changes in the Facial Skeleton with Aging: Implications and Clinical Applications in Facial Rejuvenation. Aesth Plast Surg 2012;36:753‑760. https://doi.org/10.1007/s00266-012-9904-3
- Yiannakopoulou E. Serious and long-term adverse events associated with the therapeutic and cosmetic use of botulinum toxin. Pharmacology 2015;95:65‑9. https://doi.org/10.1159/000370245
- Cohen JL, Scuderi N. Safety and Patient Satisfaction of AbobotulinumtoxinA for Aesthetic Use: A Systematic Review. Aesthet Surg J 2017;37(S1)32‑44. https://doi.org/10.1093/asj/sjx010
- Santamato A. Safety and efficacy of incobotulinumtoxinA as a potential treatment for poststroke spasticity. Neuropsychiatr Dis Treat 2016;12:251‑63. https://doi.org/10.2147/ndt.s86978
- Prager W, Nogueira Teixeira D, Leventhal PS. IncobotulinumtoxinA for aesthetic Indications: A Systematic Review of Prospective Comparative Trials. Dermatol Surg 2017;43(7):959‑966. https://doi.org/10.1097/dss.0000000000001076

