Reversibilidad de la oclusión vascular ocular mediante hialuronidasa retrobulbar.
Modelo experimental
Introducción
La ceguera asociada con la infiltración facial de ácido hialurónico (AH) es una complicación poco común pero devastadora1. Durante la inyección de AH se ha podido observar cómo la presión ejercida durante la inyección sobrepasa la presión sistólica en el vaso implicado y el material es capaz de viajar en sentido retrógrado2,3. Además, cuando dicha presión de inyección desaparece al dejar de presionar el émbolo, el material puede continuar su trayecto anterógrado movido por la presión sistólica y producir una embolización a distancia.
La hialuronidasa puede disolver potencialmente el relleno intravascular y mejorar la perfusión a nivel cutáneo, pero su utilidad en el tratamiento de la pérdida visual asociada a tratamientos con AH no ha sido demostrada4‑6.
Como recomendaciones, ante la aparición de signos de inyección intravascular inadvertida en el área periocular, se encuentran: detener la inyección, colocar al paciente en posición supina y enviar al paciente a un servicio de emergencias donde el oftalmólogo iniciará maniobras para descender la presión intraocular e intentará movilizar el émbolo. La inyección subcutánea repetida de hialuronidasa en áreas de isquemia cutánea relacionadas con tratamientos cosméticos ha sido ampliamente utilizada con éxito y está incluida en protocolos internacionales de manejo de complicaciones secundarias al empleo de materiales de relleno7‑9.
Sin embargo, la administración retrobulbar de dosis altas de hialuronidasa en casos de pérdida visual ha obtenido en la literatura resultados muy limitados (Figura 1)4,6,10.
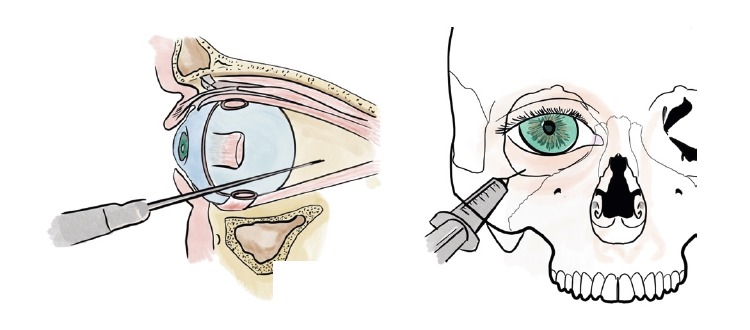
En cuanto a estudios en modelos experimentales, se han encontrado solo 2 en la revisión de la literatura11,12, de los cuales únicamente uno de ellos considera efectiva la hialuronidasa retrobulbar12.
Dado que la técnica de inyección no está exenta de riesgos13‑15, resulta necesario disponer de evidencia científica suficiente para poder concluir que el uso de hialuronidasa retrobulbar es útil en las complicaciones vasculares embólicas relacionadas con la inyección de materiales de relleno periocular.
El propósito de este estudio es evaluar el efecto de la inyección retrobulbar de hialuronidasa tras la oclusión de la arteria oftálmica por AH en un modelo experimental animal.
Material y método
Este estudio fue aprobado por el Comité Institucional de Bienestar y Ética Animal de la Universidad Cardenal Herrera CEU (Moncada, Valencia). Todos los estudios se realizaron de acuerdo con las pautas para el cuidado y uso de los animales de laboratorio. Se utilizaron para el estudio un total de 9 conejos blancos New Zealand, con un peso entre 3,0 y 5,5 kg. El estudio se llevó a cabo en el Centro Experimental de Animales de la Universidad CEU. Los conejos permanecieron anestesiados y monitorizados durante todo el estudio. La anestesia de los conejos se indujo, mediante inyección intravenosa a través de la vena marginal de la oreja, con ketamina 4 mg/kg, dexmedetomidina 0,05 mg/kg, midazolam 1 mg/kg y metadona 0,5 mg/kg (Figura 2).
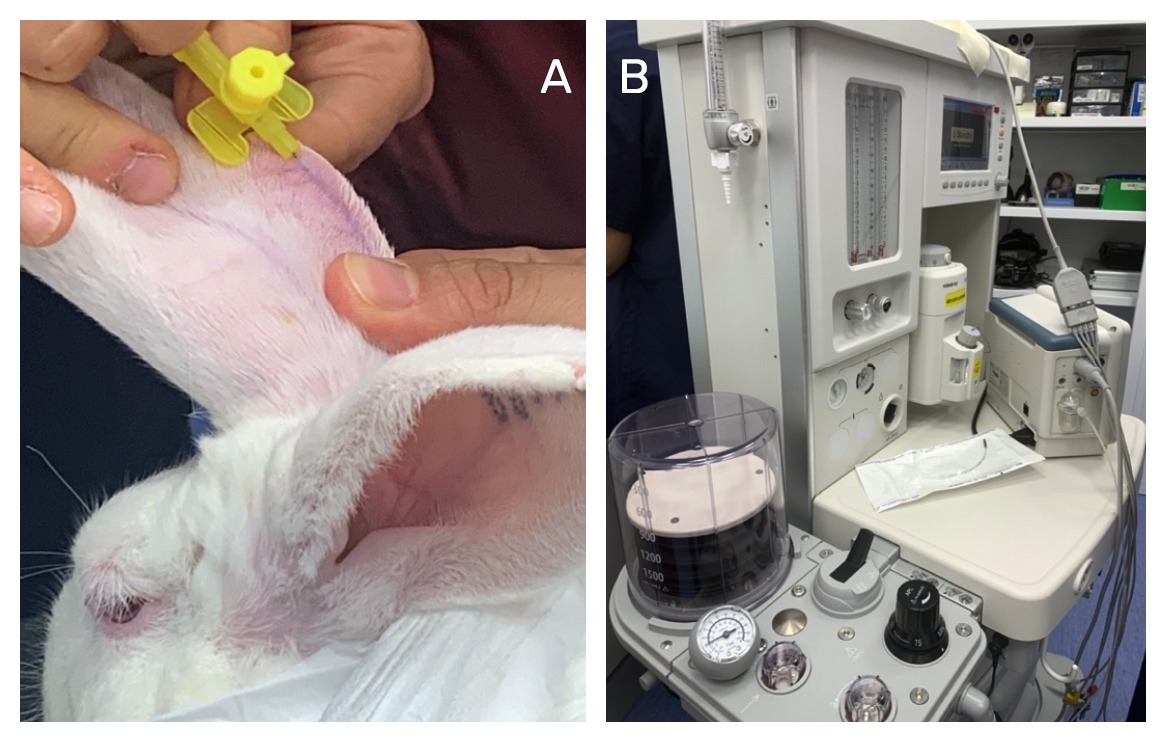
La oclusión selectiva de la arteria oftálmica de uno de los ojos de cada conejo (caso) fue guiada por radiología intervencionista tras realizar la cateterización de la arteria carótida. Fue confirmada mediante retinoscopia y electrorretinograma (ERG).
Tras confirmarse la pérdida de la función retiniana, se inyectaron 3000 UI de hialuronidasa retrobulbar a los 5 minutos, y una nueva dosis de igual cantidad a los 30 minutos si no se observaba la reperfusión retiniana. La fotografía del fondo de ojo y los cambios en el ERG se registraron a los 5, 30, 60, y 90 minutos tras la oclusión para confirmar la recuperación de la función retiniana (Figura 3).
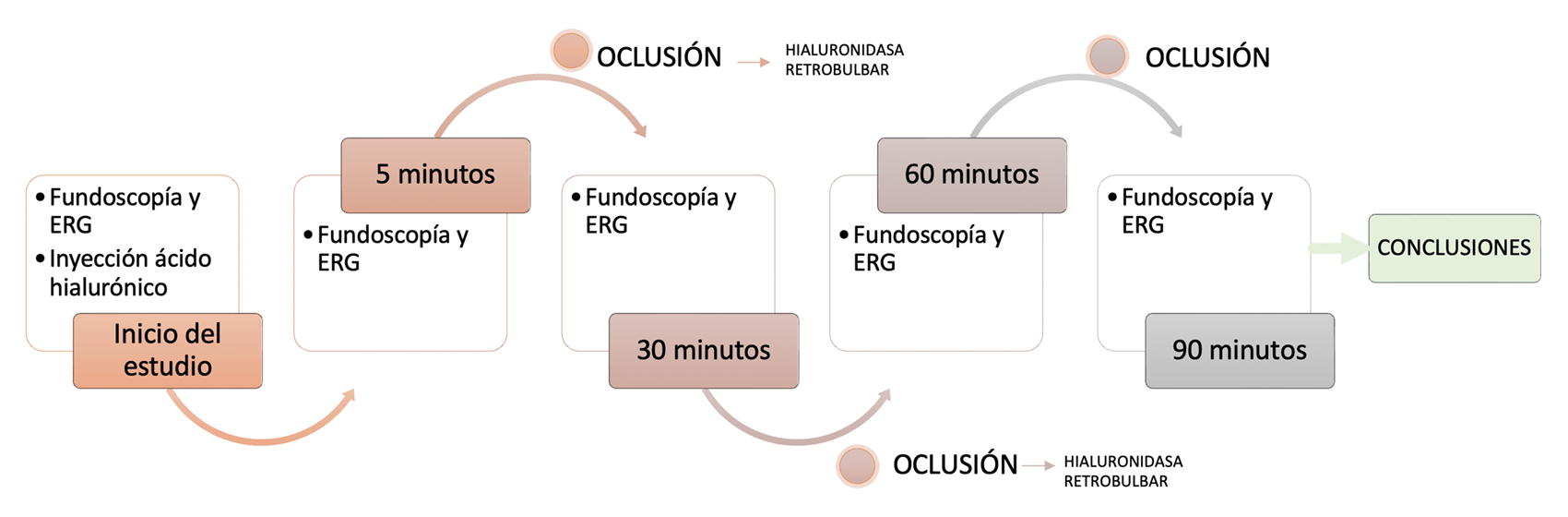
Los análisis estadísticos se realizaron utilizando el software SPSS, versión 16.0 (SPPS Inc., Chicago, IL, EE. UU.). Dado el pequeño tamaño de la muestra, se decidió utilizar pruebas no paramétricas, como la prueba de Wilcoxon para comparar el rango medio del ERG en circunstancias escotópicas o fotópicas. Se consideró significativo un valor de p igual o inferior a 0,05.
Resultados
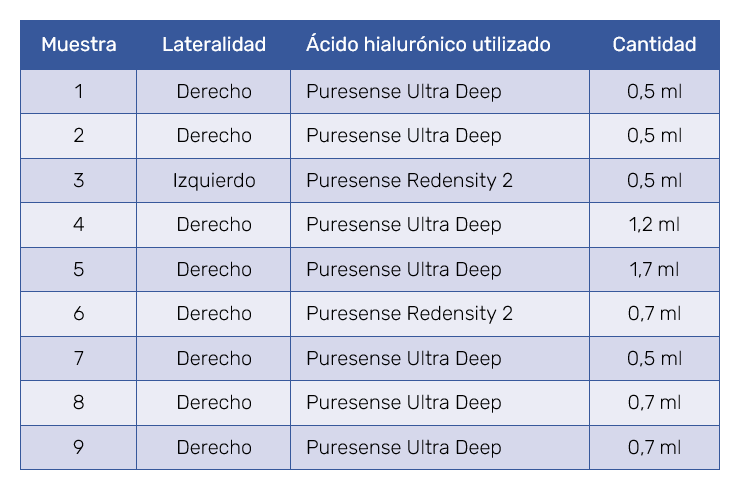
De los 9 conejos del estudio, uno de ellos sufrió un tromboembolismo pulmonar y otro tuvo una rotura de la arteria carótida, por lo que solo 7 conejos fueron finalmente incluidos (n=14). En los 7 ojos seleccionados como caso se consiguió la oclusión vascular completa. La oclusión de la arteria oftálmica se obtuvo con un volumen variable entre 0,5 y 1,7 ml de AH. En dos conejos se utilizó Teosyal® Puresense Redensity 2, y en cinco Teosyal® Puresense Ultra Deep (ambos de Teoxane, Ginebra, Suiza). En un sujeto se ocluyó el ojo izquierdo y en los otros seis se ocluyeron los ojos derechos (Tabla I).
El segmento anterior del ojo, el fondo, el reflejo de la luz y el reflejo de la córnea fueron normales y simétricos previos a la oclusión. También el ERG fue normal en todos los sujetos.
Cambios en el ERG y en el fondo de ojo
En todos los conejos se consiguió una oclusión con el AH (T0) con la disminución de las ondas a y b del ERG. En todos los conejos hubo un descenso generalizado del potencial eléctrico tras la oclusión, que fue medido en μV (microvoltios). Ninguno de ellos recuperó el potencial inicial y, por tanto, la función visual. Tras la oclusión, se evaluó la función retiniana a los 5 (T0), 30 (T1), 60 (T2) y 90 (T3) minutos, tanto en el ERG escotópico como en el fotópico.
Previo a la oclusión de la arteria, todos los conejos mostraron una electrorretinografía normal con una forma de onda a (desviación negativa inicial) seguida de una forma de onda b (desviación positiva). Tras la oclusión de la arteria, el fondo de ojo se observó más pálido que al inicio, debido a la disminución de flujo sanguíneo coroideo y, además, se observó la ausencia de irrigación en las ramas de la arteria oftálmica y edema del nervio óptico, que se correlacionaron con la ausencia de actividad en el ERG (Figura 4). El reflejo de luz y el reflejo corneal del ojo desaparecieron. Por otro lado, la conjuntiva se congestionó y la cámara anterior y vítrea del ojo presentaron turbidez. De los siete ojos con la arteria oftálmica completamente ocluida, ninguno mostró una mejoría en la perfusión retiniana.

El ERG mostró un aplanamiento significativo en la prueba de Wilcoxon a los 5, 30, 60 y 90 minutos de la oclusión en condiciones escotópicas: onda a (p=0,018; p=0,018; p=0,018 y p=0,043 respectivamente) y onda b (p=0,018; p=0,018; p=0,018 y p=0,018 respectivamente) (Figura 5). Lo mismo se observó en condiciones fotópicas: onda a (p=0,018; p=0,018; p=0,018 y p=0,018) y onda b (p=0,018; p=0,018; p=0,018 y p=0,018) (Figura 6).


Discusión
La inyección de rellenos faciales es uno de los procedimientos que se realiza con mayor frecuencia en dermatología y medicina estética. Atendiendo al último informe de la Sociedad Internacional de Cirugía Estética Plástica (ISAPS)16, aproximadamente 5.279.344 inyecciones de AH fueron administradas en el 2021. Lo que supone un aumento del 30,3% respecto al año 2020 y hasta un 60,1% respecto al año 2017. Paralelamente, y dado el gran volumen de inyecciones de AH que se practican junto a la gran heterogeneidad de profesionales que pueden administrarlos, el número de casos-complicaciones relacionadas con estos procedimientos se incremente de manera sustancial. Por ello un adecuado manejo de las complicaciones es esencial.
El uso de hialuronidasa retrobulbar fue propuesto por primera vez por un comité de expertos en base a las observaciones realizadas en cadáver sobre la capacidad de la hialuronidasa de atravesar la pared vascular y difundir al interior del vaso sanguíneo17. En una reunión organizada por Allergan, “ALFA executive consultant meeting”, celebrada en Nueva York en noviembre de 2013, Fagien, perteneciente al comité de expertos, sugirió que la hialuronidasa podría ser usada en casos de oclusión arterial por hialurónico al igual que se utiliza para disolver hemorragias vítreas18. El razonamiento que se aplicó es que la hialuronidasa inyectada en el espacio retrobulbar atravesaría la pared de las arterias oftálmica, central de la retina o ciliares posteriores introduciéndose en la circulación ocular. El enzima sería entonces transportado y difundido a través de los vasos hasta alcanzar el lugar donde estuviera el émbolo de AH para poder disolverlo. No existe evidencia de que la hialuronidasa pueda atravesar la esclera y alcanzar la coroides de la retina. Los autores describieron la técnica que debería utilizarse para la inyección retrobulbar de hialuronidasa y, aunque advirtieron de que el efecto beneficioso es teórico, ya que no se basa en ninguna evidencia, comenzó a ser incorporado en todas las guías clínicas de manejo de la pérdida visual asociada a rellenos perioculares17,19‑26.
La arteria central de la retina cuando abandona la arteria oftalmica entra en el espesor del nervio óptico quedando cubierta por 3 capas meníngeas. La arteria oftálmica se encuentra muy posterior en la órbita, a nivel del ápex. Esto hace que conseguir aproximarse tanto a la arteria como para inundarla con hialuronidasa, considerando el volumen total de la órbita (15 cm³), sea complejo. Lo que hace pensar que el enzima tiene pocas posibilidades de atravesar las capas meníngeas para penetrar en la luz de la arteria central de la retina27.
Los estudios recomiendan usar entre 450 a 600 UI. En el estudio publicado por DeLorenci et al18 sugirieron protocolos de altas dosis de hialuronidasa (3000 UI) para promover la degradación completa del relleno de AH. Este resultado fue respaldado por el estudio experimental realizado por Lee28, donde 3 de los 4 conejos recuperan la función visual. Sin embargo, en nuestro estudio ninguno de los 7 conejos recuperó la visión tras la inyección repetida de altas dosis de hialuronidasa retrobulbar. Este resultado induce a recomendar máxima prudencia en el tratamiento con AH de aquellas regiones más susceptibles de poder presentar embolizaciones, como podría ser la región glabelar o el área nasal, especialmente cuando se practican técnicas de rinomodelación para corregir defectos de la técnica quirúrgica debido a su capacidad de alterar las estructuras anatómicas previas29.
Conclusión
En este modelo de conejo, las inyecciones de 3000 UI de hialuronidasa retrobulbar, administradas 5 y 30 minutos después de la oclusión no lograron revertir la obstrucción ni restaurar la función después de la oclusión con AH de la arteria oftálmica.
Pese a que se utilizaron dosis altas de hialuronidasa, dentro del tiempo estimado de supervivencia tras la isquemia, no se consiguió revertir el evento isquémico. Consideramos que la inyección de hialuronidasa retrobulbar no es efectiva para combatir la oclusión vascular con AH.
Declaración
Los autores han realizado el presente trabajo becados por la Sociedad Española de Medicina Estética (SEME).
Premio
A la presentación de este trabajo, en el Congreso SEME 2023 en Málaga, le fue concedido el Premio a la Mejor Comunicación Libre.
Bibliografía
- Vargas-Laguna E, García-Gavín J, Bárcena-Ruiz E. Safety in Dermatologic Procedures: Vascular Occlusion by Filling Materials. Actas Dermosifiliogr (Engl Ed). 2021 May 10:S0001‑7310(21)00177‑0. English, Spanish. https://doi.org/10.1016/j.ad.2021.04.007
- McCleve DE, Goldstein JC. Blindness secondary to injections in the nose, mouth, and face: cause and prevention. Ear Nose Throat J. 1995 Mar;74(3):182‑8. https://doi.org/10.1177/014556139507400314
- Cho KH, Dalla Pozza E, Toth G, Bassiri Gharb B, Zins JE. Pathophysiology Study of Filler-Induced Blindness. Aesthet Surg J. 2019 Jan 1;39(1):96‑106. https://doi.org/10.1093/asj/sjy141
- Navarro-Hernandez E, Pérez-López M. Effectiveness of retrobulbar hyaluronidase in the treatment of visual loss caused by periocular hyaluronic acid injection. A systematic review. Arch Soc Esp Oftalmol (Engl Ed). 2022 Sep;97(9):521‑538. https://doi.org/10.1016/j.oftale.2022.06.005
- Zhu GZ, Sun ZS, Liao WX, Cai B, Chen CL, Zheng HH, Zeng L, Luo SK. Efficacy of Retrobulbar Hyaluronidase Injection for Vision Loss Resulting from Hyaluronic Acid Filler Embolization. Aesthet Surg J. 2017 Dec 13;38(1):12‑22. https://doi.org/10.1093/asj/sjw216
- Chesnut C. Restoration of Visual Loss With Retrobulbar Hyaluronidase Injection After Hyaluronic Acid Filler. Dermatol Surg. 2018 Mar;44(3):435‑437. https://doi.org/10.1097/DSS.0000000000001237
- Myung Y, Yim S, Jeong JH, Kim BK, Heo CY, Baek RM, Pak CS. The Classification and Prognosis of Periocular Complications Related to Blindness following Cosmetic Filler Injection. Plast Reconstr Surg. 2017 Jul;140(1):61‑64. https://doi.org/10.1097/PRS.0000000000003471
- Carruthers JDA, Fagien S, Rohrich RJ, Weinkle S, Carruthers A. Blindness caused by cosmetic filler injection: a review of cause and therapy. Plast Reconstr Surg. 2014 Dec;134(6):1197‑1201. https://doi.org/10.1097/PRS.0000000000000754
- King M, Convery C, Davies E. This month's guideline: The Use of Hyaluronidase in Aesthetic Practice (v2.4). J Clin Aesthet Dermatol. 2018 Jun;11(6):E61‑E68.
- Hu XZ, Hu JY, Wu PS, Yu SB, Kikkawa DO, Lu W. Posterior Ciliary Artery Occlusion Caused by Hyaluronic Acid Injections Into the Forehead: A Case Report. Medicine (Baltimore). 2016 Mar;95(11):e3124. https://doi.org/10.1097/MD.0000000000003124
- Hwang CJ, Mustak H, Gupta AA, Ramos RM, Goldberg RA, Duckwiler GR. Role of Retrobulbar Hyaluronidase in Filler-Associated Blindness: Evaluation of Fundus Perfusion and Electroretinogram Readings in an Animal Model. Ophthalmic Plast Reconstr Surg. 2019 Jan/Feb;35(1):33‑37. https://doi.org/10.1097/IOP.0000000000001132
- Hwang CJ, Perry JD. Effectiveness of Retrobulbar Hyaluronidase Injection in an Iatrogenic Blindness Rabbit Model Using Hyaluronic Acid Filler Injection. Plast Reconstr Surg. 2020 Mar;145(3):658e‑660e. https://doi.org/10.1097/PRS.0000000000006583
- Faccenda KA, Finucane BT. Complications of regional anaesthesia Incidence and prevention. Drug Saf. 2001;24(6):413‑42. https://doi.org/10.2165/00002018-200124060‑00002
- Babu N, Kumar J, Kohli P, Ahuja A, Shah P, Ramasamy K. Clinical Presentation and Management of Eyes with Globe Perforation during Peribulbar and Retrobulbar Anesthesia: A Retrospective Case Series. Korean J Ophthalmol. 2022 Feb;36(1):16‑25. https://doi.org/10.3341/kjo.2021.0090
- Rodriguez-Coleman H, Spaide R. Ocular complications of needle perforations during retrobulbar and peribulbar injections. Ophthalmol Clin North Am. 2001 Dec;14(4):573‑9. https://doi.org/10.1016/s0896-1549(05)70257‑1
- ISAPS [Internet]. Citado el 29 de junio de 2023. https://www.isaps.org
- Ugradar S, Diniz S, Hoenig J, Goldberg RA. Generation of Filler Emboli as a Mechanism for Filler-Related Blindness. Dermatol Surg. 2021 Feb 1;47(2):235‑237. https://doi.org/10.1097/DSS.0000000000002869
- DeLorenzi C. New High Dose Pulsed Hyaluronidase Protocol for Hyaluronic Acid Filler Vascular Adverse Events. Aesthet Surg J. 2017 Jul 1;37(7):814‑825. https://doi.org/10.1093/asj/sjw251
- Hyaluronidase (Vitrase)--ISTA: hyaluronidase--ISTA pharmaceuticals. Drugs R D. 2003;4(3):194‑7. https://doi.org/10.2165/00126839-200304030‑00010
- Walker L, King M. This month's guideline: Visual Loss Secondary to Cosmetic Filler Injection. J Clin Aesthet Dermatol. 2018 May;11(5):E53‑E55.
- King M. This month's guideline: ACE emergency kit v1.2. J Clin Aesthet Dermatol. 2018 Apr;11(4):61‑62.
- Li KT, Huang YH, Chen CH, Chou LW. Delayed-onset cerebral infarction after cosmetic facial injection using hyaluronic acid. J Formos Med Assoc. 2016 Jul;115(7):587‑8. https://doi.org/10.1016/j.jfma.2015.11.012
- de Lacerda D. Prevention and management of iatrogenic blindness associated with aesthetical filler injections. Dermatol Ther. 2018 Nov;31(6):e12722. https://doi.org/10.1111/dth.12722
- Beleznay K, Carruthers JD, Humphrey S, Jones D. Avoiding and Treating Blindness From Fillers: A Review of the World Literature. Dermatol Surg. 2015 Oct;41(10):1097‑117. https://doi.org/10.1097/DSS.0000000000000486
- Khan TT, Colon-Acevedo B, Mettu P, DeLorenzi C, Woodward JA. An Anatomical Analysis of the Supratrochlear Artery: Considerations in Facial Filler Injections and Preventing Vision Loss. Aesthet Surg J. 2017 Feb;37(2):203‑208. https://doi.org/10.1093/asj/sjw132
- Prado G, Rodríguez-Feliz J. Ocular Pain and Impending Blindness During Facial Cosmetic Injections: Is Your Office Prepared? Aesthetic Plast Surg. 2017 Feb;41(1):199‑203. https://doi.org/10.1007/s00266-016‑0728‑4
- Fathi R, Biesman B, Cohen JL. Commentary on: An Anatomical Analysis of the Supratrochlear Artery: Considerations in Facial Filler Injections and Preventing Vision Loss. Aesthet Surg J. 2017 Feb;37(2):209‑211. https://doi.org/10.1093/asj/sjw188
- Lee W, Oh W, Ko HS, Lee SY, Kim KW, Yang EJ. Effectiveness of Retrobulbar Hyaluronidase Injection in an Iatrogenic Blindness Rabbit Model Using Hyaluronic Acid Filler Injection. Plast Reconstr Surg. 2019 Jul;144(1):137‑143. https://doi.org/10.1097/PRS.0000000000005716
- Ramos HHA, Freire L, Cavallieri F, Frota AE, Ragazzo R, Jurado JRP. Management of Patients Seeking Surgical Rhinoplasty with Previous Nasal Injections of Hyaluronic Acid. Aesthetic Plast Surg. 2021 Aug;45(4):1675‑1682. https://doi.org/10.1007/s00266-021‑02136‑3





