Reducción del panículo adiposo
localizado mediante un sistema
de enfriamiento controlado:
estudio clínico, ecográfico e histológico
Introducción
El tratamiento de la remodelación corporal está muy demandado actualmente en medicina estética. Desde su introducción en los años 60, la liposucción ha sido el método más eficaz para reducir la grasa y producir un remodelado del contorno corporal1. A lo largo los años, la técnica se ha perfeccionado y se ha introducido la liposucción asistida con láser2. Sin embargo, las técnicas mencionadas no están exentas de efectos adversos, como los riesgos propios de la anestesia o las infecciones. Hoy en día, los pacientes piden técnicas menos invasivas, con pocos efectos adversos y sin baja laboral; esto ha propiciado que ganen terreno procedimientos como la electroporación, mesoterapia, infiltración de desoxicolato de sodio, carboxiterapia, ultrasonidos, cavitación, radiofrecuencia y láser de baja densidad de potencia, entre otros3.
La eliminación de grasa mediante enfriamiento controlado (crioadipólisis), introducida en 2007 y aprobada por la FDA (Food and Drug Administration) en 2010, se ha convertido en un método de reducción del tejido graso no invasivo con buenos resultados. Los últimos estudios han puesto en evidencia la sensibilidad del tejido graso al frío, capaz de inducir apoptosis o muerte diferida de las células adiposas sin producir necrosis y sin dañar los tejidos circundantes3‑5.
Para que se obtenga el efecto de crioadipólisis es necesario el conocimiento de los diferentes perfiles térmicos de los ácidos grasos más comunes para que se alcance el fenómeno de cristalización y apoptosis secundaria. En la mayoría de ellos es necesario llegar a temperaturas iguales o inferiores a los +10°C, y aquellos sistemas que no consigan alcanzar estas temperaturas en el interior de la grasa no serán efectivos5. Es fundamental emplear un aplicador de frío que produzca la succión suficiente de la piel para provocar una isquemia parcial sobre el tejido adiposo, a fin de disminuir el aumento de riego sanguíneo secundario a la bajada de temperatura durante el tratamiento.
El objetivo del procedimiento de crioadipólisis es realizar un enfriamiento controlado del tejido subcutáneo llegando a temperaturas de apoptosis de los adipocitos (<10°C) pero respetando los tejidos adyacentes5, produciendo de esta manera una reacción inflamatoria que se inicia aproximadamente a los 2 días post-exposición, teniendo un pico máximo entre las 2 y 4 semanas que persiste hasta los 90 días. Histológicamente se observa un infiltrado perivascular de histiocitos, neutrófilos y linfocitos6,7. Esta inflamación genera una apoptosis de los adipocitos, que luego son digeridos por los macrófagos para ser eliminados a lo largo de los meses, sin afectar los niveles de lípidos en sangre ni la función hepática7,8.
El objetivo del presente estudio es valorar la efectividad del tratamiento de eliminación de tejido graso localizado en área abdominal y flancos con un sistema de crioadipólisis según peso, antropometría, ecografía, medida de perímetros, fotografía y estudio histológico mediante biopsia grasa.
Materiales y método
El presente estudio prospectivo y controlado se basa en el análisis de un tratamiento de crioadipólisis realizado en Clínica Fajardo (Málaga), para la reducción de la grasa localizada en abdomen y flancos mediante un sistema que realiza simultáneamente succión del tejido y enfriamiento de esta área. El enfriamiento es progresivo y se tarda en alcanzar -8°C unos 4 a 5 minutos; alcanzada dicha temperatura, ésta se mantiene hasta el final del tratamiento.
Se incluyeron en el estudio 8 pacientes de ambos sexos (6 mujeres y 2 hombres), fototipos II a IV, con depósitos de grasa localizada en área del abdomen y costados, con edades de 29 a 55 años (media de 44 años).
Los criterios de exclusión utilizados, una vez realizado el historial médico, fueron: ser menor de 18 años, embarazo, insuficiencia renal grave, insuficiencia hepática grave, diabetes, cáncer, estados febriles, enfermedad de Raynaud (crioglobulinemia), enfermedades sistémicas con afectación cutánea, urticaria por frío y presencia de cicatrices antiguas y/o recientes en el área a tratar.

Una vez obtenidas las medidas, iconografía, y con el paciente en posición semisentado, se coloca una membrana crioprotectora de celulosa impregnada en glicerina y agua (Cool Gel Pad) sobre la zona de tratamiento a realizar, que también actúa como barrera anticongelante para la piel.
El equipo empleado fue el modelo Cooltech®, con aplicador Straight HP® (Cocoon Medical, Barcelona, España). Se programan los parámetros, se coloca el manípulo sobre la membrana y se activa la succión. Al llegar al límite programado de succión, comienza el descenso de la temperatura hasta llegar a -8°C, que debe mantenerse por 60 minutos (Figura 1). Los parámetros citados se emplearon en todos los pacientes. En todos los pacientes se trató la región abdominal, que fue dividida en 4 zonas: dos zonas abdominales centrales paraumbilicales, y 2 zonas laterales, una zona en flanco derecho y una zona en flanco izquierdo (Figura 2).

Una vez finalizado el tratamiento se aplicó sobre el área tratada una crema hidratante y se aconsejó no tomar el sol durante los dos o tres días posteriores al mismo.
La valoración de resultados se realizó de manera individual a través de:
- Iconografía, realizada mediante la cámara de fotos Sony Alfa 390 PT1855 MM (Sony Corporation, Tokyo, Japón).
- Estudio antropométrico, realizado mediante Bioimpedancia (Tanita® Mod. BNC 420 MA, Tanita Corporation, Illinois, USA).
- Medición de perímetros con cinta métrica.
- Ecografía de grasa de la zona obtenida mediante ecógrafo Toshiba® Sonolayer SS11‑14UA con una sonda de 3 MHz (Thosiba Inc., Tokyo, Japón).
- Biopsia de grasa con tinción de hematoxilina-eosina, estudiada con Microscopio Leica® DM1000, Cámara Leica® ICC50, entre 4 y 40 aumentos (Leica, Wetzlar, Alemania).
Criterios de evaluación
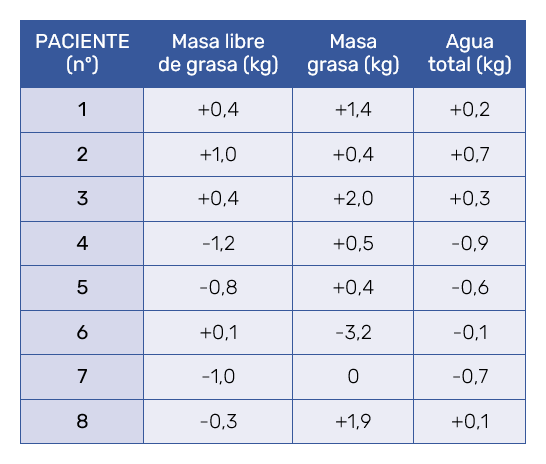
Los parámetros a valorar fueron el sexo, el peso y perímetro abdominal (3 medidas: la primera a nivel del ombligo, y las otras dos a 5 cm por encima y 5 cm por debajo del ombligo, respectivamente. Se realizaron ecografías bidimensionales de los flancos para detectar posibles pérdidas del espesor del tejido y en la zona infraumbilical (que no fue tratada) como valor de contraste. También se valoró la masa libre de grasa, masa grasa y agua total por bioimpedancia.
Se realizaron visitas de control postratamiento al mes y a los dos meses, y se evaluaron los resultados a través de encuestas de satisfacción a los pacientes y a los médicos evaluadores. Para la valoración de la disminución del perímetro abdominal se utilizaron escalas semicuantitativas entre 1 a 5. En una escala similar se valoraron los resultados ecográficos. En ambas escalas se asignaron los siguientes valores: 1 = ningún resultado, 2 = resultado escaso, 3 = buen resultado, 4 = resultado muy bueno, 5 = resultado excelente.
En todos los casos se procedió a tomar iconografía.
En un solo caso se realizó estudio histológico a las 4 semanas del tratamiento en una muestra de tejido graso tomada por biopsia dentro del área tratada. En este paciente se realizó el tratamiento en dos zonas diferentes, en la mitad del abdomen y en el flanco contralateral, para poder comparar los resultados con los de la zona no tratada a los dos meses del tratamiento. La biopsia se realizó con un trocar de 6 mm y se obtuvo un punch de piel de 5 mm. Tras la fijación del tejido graso se procedió posteriormente a una tinción con hematoxilina-eosina. Ningún otro paciente estuvo dispuesto a tener 2 cicatrices en zonas visibles. Para biopsiar la grasa abdominal es preciso emplear un trocar de suficiente diámetro, que deja una cicatriz similar a las que se obtenían en las antiguas liposucciones.
También se tuvieron en cuenta las posibles complicaciones y efectos secundarios.
Resultados
En los resultados se observó que, en todos los casos, los perímetros abdominales experimentaron una reducción del perímetro abdominal localizado a nivel del ombligo (medida 2) con una reducción media de 2,0 cm, siendo la reducción máxima de 4,8 cm. En el perímetro abdominal superior (5 cm por encima del ombligo, medida 1), solo en un caso se comprobó un incremento de 0,5 cm, mientras que en los otros siete se observó una reducción media de 1,5 cm, siendo la reducción máxima de 3,2 cm. Finalmente, en el perímetro abdominal inferior (5 cm por debajo del ombligo, medida 3), en 7 casos se observó una reducción media de 3,7 cm, siendo la reducción máxima de 5,5 cm. En un solo caso no se observó disminución ni aumento de este perímetro abdominal.

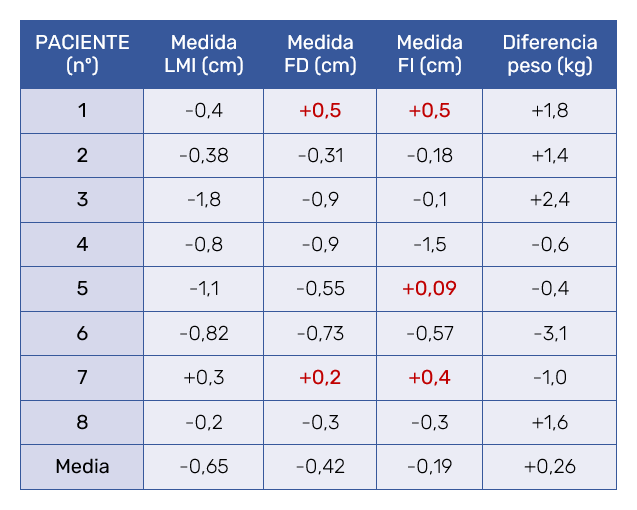
La Tabla I muestra los resultados de las medidas antropométricas obtenidas a través de la bioimpedancia, observándose una pérdida de peso media en todos los pacientes de -2,16 kg. La pérdida de peso fue mayor en hombres que en mujeres (-6,95 kg en hombres y -0,57 en mujeres). La masa libre de grasa disminuyó una media de -2,71 kg y la masa grasa aumentó 0,40 de media. Esta elevación puede venir determinada por la época donde se realizó el estudio, donde hubo aumento de peso en muchos pacientes durante el proceso de recolección de datos. Esto hace ver que el tratamiento es efectivo ya que, aun aumentando la masa grasa, hay disminución de perímetros como se verá en las siguientes tablas.
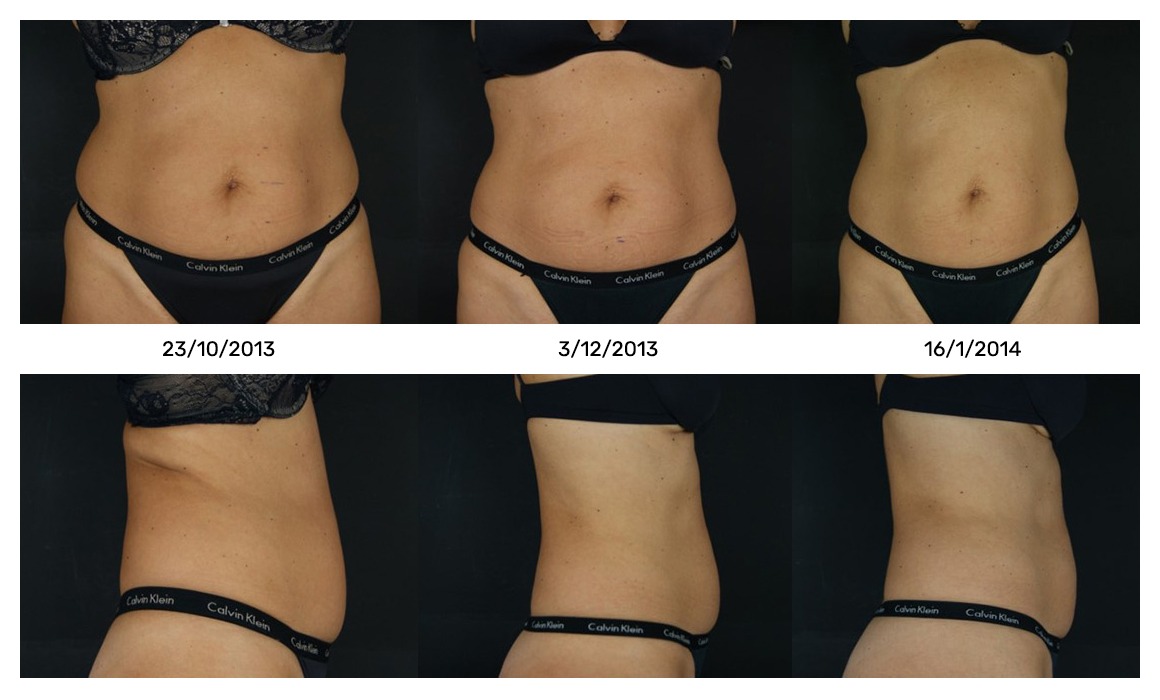
La Tabla II evidencia los resultados de reducción de diámetros medidos en tres áreas (umbilical, supraumbilical e infraumbilical) y las Figuras 3, 4 y 5 muestran las iconografías de antes y después. Se pueden observar, a las 8 semanas, reducciones medias de entre -1,48 cm a -2,98 cm realizando una única sesión, lo que apoya una vez más la eficacia del tratamiento.
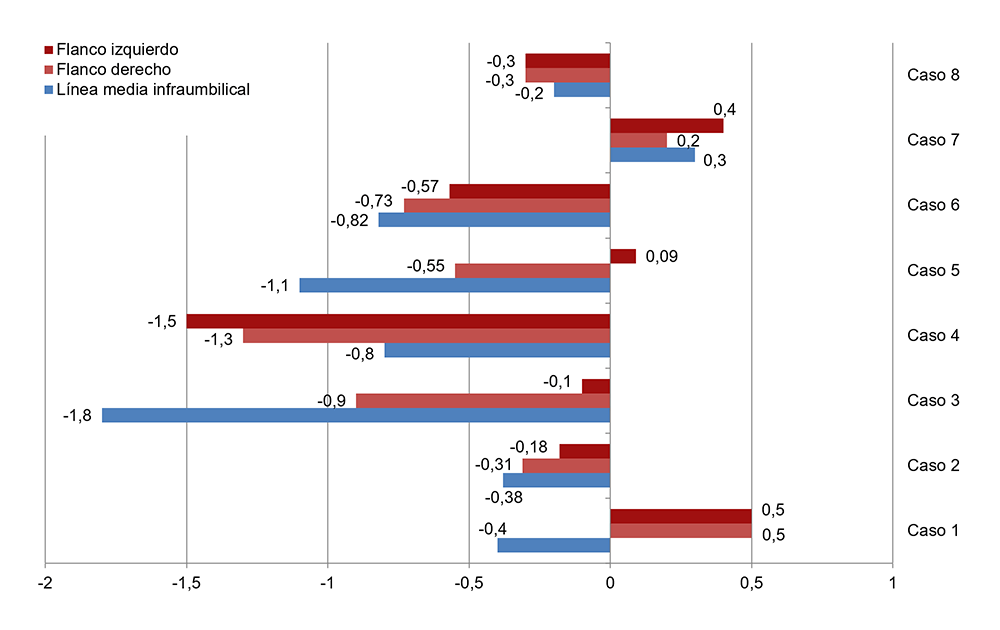
La Tabla III muestra los resultados de la ecografía grasa con reducciones medias en las tres zonas medidas (línea media infraumbilical, flanco derecho y flanco izquierdo) a las 8 semanas. Al tratarse de una medición puntual y no de contorno, las pérdidas fueron menores obteniéndose valores de -0,21 cm a -0,65 cm de media. También puede verse la diferencia entre las medidas pre y post tratamiento obtenidas por ecografía (Figura 6).


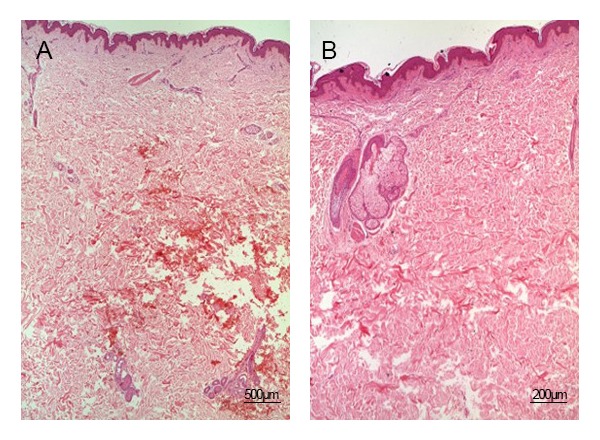
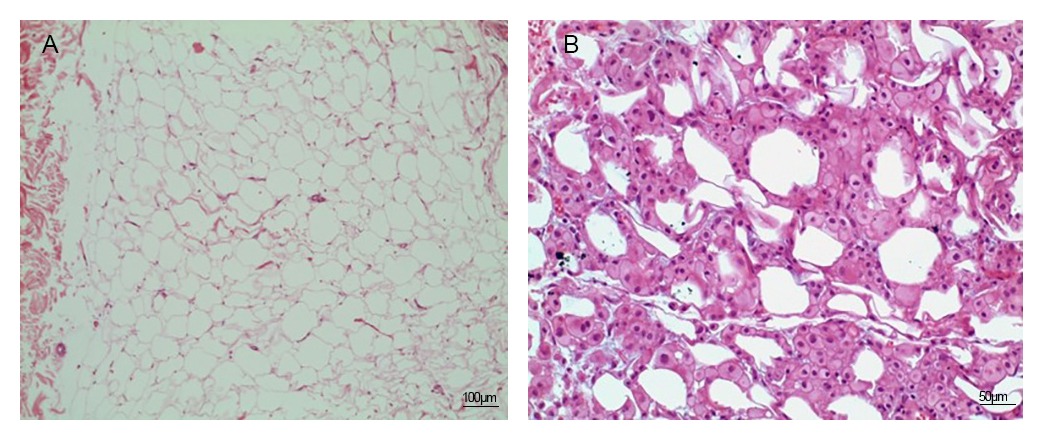
El informe histopatológico de la biopsia (Figuras 7, 8 y 9) muestra una disminución del espesor de la capa de adipocitos. En la hipodermis los tractos adiposos se han compactado (Figura 8B) y se observa imagen sugestiva de macrófagos digiriendo adipocitos (Figura 9B). No se observan necrosis ni inflamación en la epidermis, dermis e hipodermis.

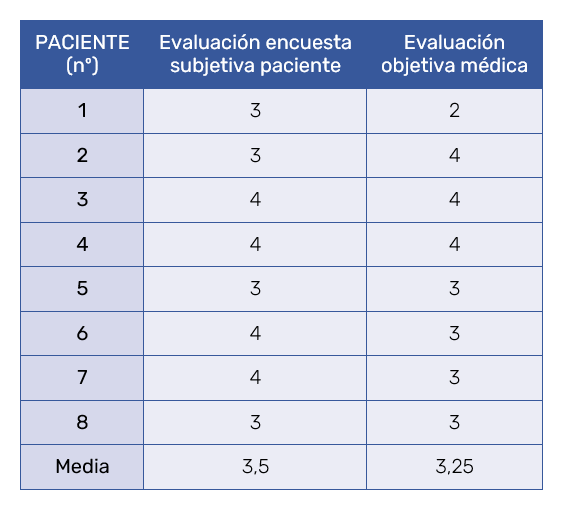
Respecto a la escala de satisfacción por parte de los pacientes se obtuvo una media de 3,5 (3 buen resultado y 4 resultado muy bueno). En la escala de valoración de los 2 investigadores que intervinieron la media fue de 3,3 (3 buen resultado y 4 resultado muy bueno) (Tabla IV).
El tratamiento no derivó en complicaciones. Los efectos secundarios fueron los propios y esperados para este tratamiento, la mayoría de pacientes lo refirió como dolor leve y alguno como moderado. Según cuantificación (escala de 1 a 5) la media fue de 2, solo dolor escaso. El eritema y edema de corta duración fueron habituales en todos los pacientes. También se observó una sensación de disestesia en el área tratada en 3 casos que duró desde unos días hasta un máximo de 2 semanas.
Discusión
En el presente estudio hubo mayor número de mujeres que de hombres, pero los resultados son evidentes en ambos sexos; por lo tanto, el sexo no sería un factor determinante para los resultados tal como informa la literatura9‑11.
Los perímetros abdominales mostraron una clara reducción en la mayoría de los pacientes, sirviendo de orientación para demostrar la efectividad del tratamiento.
La ecografía, como método objetivo de la eficacia del tratamiento, mostró una reducción del grosor del panículo adiposo. La reducción fue mayor en el área abdominal que en los flancos, dado que, por lo general, hay un menor panículo graso12.
Finalmente, la biopsia realizada ha puesto de manifiesto la eficacia del tratamiento al evidenciar eliminación gradual de adipocitos sin necrosis, rotura o inflamación residual.
La falta de efectos adversos permite sugerir que los parámetros utilizados son adecuados para reducción de los adipocitos13‑16.
El nivel de satisfacción de los pacientes es alto, pues todos los pacientes están satisfechos y continuarán con el tratamiento17.
La evaluación médica también ofrece un buen resultado respecto a la eficacia del tratamiento, llegando a tener pérdidas de hasta 5 cm en una sola sesión; lo que difícilmente se logra con cualquiera de las técnicas invasivas empleadas comúnmente en este tipo de tratamientos.
Tras valorar los datos obtenidos de los criterios de evaluación, el tratamiento con el sistema de enfriamiento por succión controlado del sistema de crioadipolisis arroja datos prometedores como tratamiento de la grasa localizada, con resultados satisfactorios para los pacientes, datos clínicos de disminución de la grasa y datos objetivos de destrucción adipocitaria sin inflamación ni necrosis.
Estos datos confirman los observados por otros autores sobre su eficacia19‑24, aun sin el efecto potenciador que se produce cuando se realiza masaje una vez terminado y retirado el dispositivo de succión18.
En otros estudios, como el nuestro, solo se observan efectos adversos leves, no duraderos y reversibles en todos los casos2,24, siendo por ello una técnica segura y efectiva. Además, queda patente la eficacia de la técnica, que se asocia con pérdidas importantes de volumen graso y con un nivel de seguridad muy alto para el paciente.
Conclusiones
Este sistema de crioadipólisis es efectivo para la reducción de la grasa corporal, evidenciado tanto clínicamente como a través de la ecografía y del estudio histológico.
Es destacable la alta satisfacción de los pacientes con el tratamiento.
Es preciso seguir investigando y realizar nuevos estudios, con seguimientos más largos y bien controlados. Asimismo, es preciso enrolar un mayor número de pacientes por estudio a fin de aumentar las posibilidades de realizar biopsias y estudios histológicos que permitan una mejor comprensión de la apoptosis inducida por el frío.
Conflicto de intereses
Los autores manifiestan que no tienen conflicto de intereses.
Bibliografía
- Khanna A, Filobbos G. Avoiding unfavourable outcomes in liposuction. Indian J Plast Surg. 2013; 46(2): 393‑400. https://doi.org/10.4103/0970-0358.118618
- Pereira-Netto D, Montano-Pedroso JC, Aidar ALES, Marson WL, Ferreira LM.Laser-Assisted Liposuction (LAL) Versus Traditional Liposuction: Systematic Review. Aesthetic Plast Surg. 2018; 42(2):376‑383. https://doi.org/10.1007/s00266-018-1085-2
- Jalian HR, Avram MM. Body Contouring: The Skinny on Noninvasive Fat Removal. Semin Cutan Med Surg 2012; 31:121‑125. https://doi.org/10.1016/j.sder.2012.02.004
- Derrick CD, Shridharani SM, Broyles JM. The Safety and Efficacy of Cryolipolysis: A Systematic Review of Available Literature. Aesthet Surg J. 2015; 35(7):830‑6. https://doi.org/10.1093/asj/sjv039
- Manstein D, Laubach H, Watanabe K, Farinelli W, Zurakowski D, Anderson R. Selective Cryolysis: A Novel Method of Non‑Invasive Fat Removal. Lasers Surg Med. 2008; 40:595‑604. https://doi.org/10.1002/lsm.20719
- Avram MM, Harry RS. Cryolipolysis for subcutaneous fat layer reduction. Lasers Surg Med. 2009; 41(10):703‑8. Erratum in: Lasers Surg Med. 2012;44(5):436. https://doi.org/10.1002/lsm.20864
- Klein KB, Zelickson B. Riopelle JG, Okamoto E. Bachelor E, Harry RS. Preciado JA. Non‑Invasive Cryolipolysis for Subcutaneous Fat Reduction Does Not Affect Serum Lipid Levels or Liver Function Tests. Lasers Surg Med. 2009; 41:785‑790. https://doi.org/10.1002/lsm.20850
- Loap S, Lathe R. Mechanism Underlying Tissue Cryotherapy to Combat Obesity/Overweight: Triggering Thermogenesis. J Obes. 2018 2:578964. https://doi.org/10.1155/2018/5789647
- Wells JCK. Sexual dimorphism of body composition. Vol. 21, Best Practice and Research: Clinical Endocrinology and Metabolism. 2007. p. 415‑3. https://doi.org/10.1016/j.beem.2007.04.007
- Karastergiou K, Smith SR, Greenberg AS, Fried SK. Sex differences in human adipose tissues - The biology of pear shape. Vol. 3, Biology of Sex Differences. BioMed Central; 2012. p. 13. https://doi.org/10.1186/2042-6410-3-13
- Van Den Beukel JC, Grefhorst A, Hoogduijn MJ, Steenbergen J, Mastroberardino PG, Dor FJMF, et al. Women have more potential to induce browning of perirenal adipose tissue than men. Obesity. 2015; 23(8):167. https://doi.org/10.1002/oby.21166
- Wells JCK, Fewtrell MS. Measuring body composition. Arch Dis Child. 2006; 91(7):612‑7. https://doi.org/10.1136/adc.2005.085522
- Dierickx CC, Mazer JM, Sand M, Koenig S, Arigon V. Safety, tolerance, and patient satisfaction with noninvasive cryolipolysis. Dermatol Surg. 2013; 39(8):1209‑16. https://doi.org/10.1111/dsu.12238
- Jewell ML, Solish NJ, Desilets CS. Noninvasive body sculpting technologies with an emphasis on high-intensity focused ultrasound. Aesthetic Plast Surg. 2011; 35(5):901‑12. https://doi.org/10.1007/s00266-011-9700-5
- Jordan J. Apoptosis: muerte celular programada. Apoptosis. 2003; 22(4):253‑75.
- Kilmer SL, Burns AJ, Zelickson BD. Safety and efficacy of cryolipolysis for non-invasive reduction of submental fat. Lasers Surg Med. 2016 Jan;48(1):3‑13. https://doi.org/10.1002/lsm.22440
- Gerald E. Boey GE. Wasilenchuk JL. Enhanced Clinical Outcome with Manual Massage Following Cryolipolysis Treatment: A 4‑Month Study of Safety and Efficacy. Lasers Surg Med. 2014; 46:20‑26. https://doi.org/10.1002/lsm.22209
- Naouri M. Fat removal using a new cryolipolysis device: a retrospective study of 418 procedures.J Eur Acad Dermatol Venereol. 2017; 31(3):e158‑e160. https://doi.org/10.1111/jdv.13899
- Bernstein EF. Long‑term efficacy follow‑up on two cryolipolysis case studies: 6 and 9 years post-treatment. J Cosmet Dermatol. 2016; 15(4):561‑564. https://doi.org/10.1111/jocd.12238
- Sasaki GH, Abelev N, Tevez-Ortiz A. Noninvasive selective cryolipolysis and reperfusion recovery for localized natural fat reduction and contouring. Aesthet Surg J. 2014 Mar;34(3):420‑31. https://doi.org/10.1177/1090820X13520320
- Ingargiola MJ, Motakef S, Chung MT, Vasconez HC, Sasaki GH Cryolipolysis for fat reduction and body contouring: safety and efficacy of current treatment paradigms. Plast Reconstr Surg. 2015; 135(6):1581‑90. https://doi.org/10.1097/prs.0000000000001236
- Krueger N, Mai SV, Luebberding S, Sadick NS. Cryolipolysis for noninvasive body contouring: clinical efficacy and patient satisfaction. Clin Cosmet Investig Dermatol. 2014; 7:201‑5. https://doi.org/10.2147/ccid.s44371
- Kim J, Kim DH, Ryu HJ. Clinical effectiveness of non‑invasive selective cryolipolysis. J Cosmet Laser Ther. 2014; 16(5):209‑13. https://doi.org/10.3109/14764172.2014.946050
- Coleman SR. Sachdeva K. Egbert BM. Preciado J. Allison John. Clinical Efficacy of Noninvasive Cryolipolysis and Its Effects on Peripheral Nerves. Aesth Plast Surg. 2009; 33:482‑488. https://doi.org/10.1007/s00266-008-9286-8


