Plasma rico en plaquetas en
el tratamiento de las úlceras
de las extremidades inferiores
of ulcers of the lower extremities
Introducción
Desde el descubrimiento, en la década de los 80 del siglo XX, de la liberación de moléculas bioactivas destinadas a reparar el tejido dañado, el Plasma Rico en Plaquetas (PRP) comenzó a utilizarse en medicina regenerativa. En la siguiente década su empleo se extendió a la cirugía maxilofacial, donde se observó su capacidad estimuladora sobre la proliferación celular y su capacidad de modular la respuesta inflamatoria. Teóricamente, el PRP debería acelerar el proceso de reparación tisular por su mayor contenido en factores de crecimiento. Sobre este supuesto, se inició también el uso del PRP en el tratamiento de las úlceras1.
Úlcera cutánea
Se denomina úlcera a la herida cutánea con pérdida de sustancia que involucra la epidermis, dermis y/o sustratos profundos, y que prolonga su evolución más allá del tiempo considerado normal para su curación2; bien porque presenta escasa tendencia a la cicatrización o no alcanza su curación antes de 6 semanas de iniciado el proceso3,4.
El primer estudio nacional sobre prevalencia de úlceras en las piernas se publicó en 2004 y se estimó su incidencia en 0,16%4. Su prevalencia e impacto social aumentan paralelamente al envejecimiento de la población y conllevan un elevado gasto sanitario asociado5.
En nuestro medio, la mayoría de las úlceras de miembros inferiores son de origen vascular (85%), de las cuales, el 60% se deben a insuficiencia venosa. Las de causa neuropática suponen un 5% y el 10% restante son de etiología mixta: vasculitis, infecciones, tumores y traumatismos. El diagnóstico etiológico es de suma importancia para elegir el tratamiento óptimo de la úlcera, ya que la resolución de la causa es fundamental para la curación de la misma. Un 20% de las úlceras no evolucionan de forma favorable2; sólo el 50% de las mismas recibe el tratamiento adecuado y un 25% carece de un diagnóstico correcto7.
Función de las plaquetas y el remodelado tisular
La cicatrización es una compleja cascada de reacciones bioquímicas y celulares que podrían resumirse en 3 fases: inflamación, proliferación y remodelación.
La fase inflamatoria consta de una respuesta vascular y celular. Suele durar de 24 a 48 horas, aunque se puede prolongar hasta 2 semanas. Las primeras células en intervenir son las plaquetas activadas que promueven dos acciones diferentes: 1) hemostática, desencadenando la cascada de la coagulación y la formación del trombo; y 2) cicatrizadora, liberando los factores de crecimiento con acción quimiotáctica, angiogénica y mitogénica. La fase proliferativa es predominantemente celular, y su objetivo es la reepitelización. Se solapa con la fase inflamatoria, pues se inicia horas después del daño tisular. La zona lesionada se revasculariza, reforzándose el tejido dañado a través de la fibroplasia. La fibroplasia comienza a los 3‑5 días de la producción de la herida y se puede alargar hasta 4 semanas8. La revascularización, mediada por el factor de crecimiento vascular endotelial (VEGF) y el factor de crecimiento fibroblástico (FGF), implica la formación de neovasos en el lecho de la herida, y junto a la fibronectina y la heparina contribuyen a la migración y proliferación de células endoteliales. Es destacable que la fibroplasia se inicia cuando la inflamación disminuye y el fibroblasto es susceptible de estimulación por PDGF, FGF, y el factor de crecimiento transformador (TGF) produce colágeno tipo III, elastina, fibronectina, glicosaminoglicanos y proteinasas.
La fase de remodelación corresponde a la organización del colágeno, que depende del balance entre síntesis y destrucción del mismo. En esta fase, el colágeno tipo III es sustituido por colágeno tipo I, disminuye la densidad celular y la vascularización, se elimina el exceso de tejido neoformado y las fibras de colágeno se disponen con una adecuada orientación. Esta fase comienza a las 3 semanas de la aparición de la herida y puede prolongarse hasta un año.
Cronificación de la herida
En las úlceras crónicas, la fase inflamatoria está prolongada anormalmente por un elevado nivel de citoquinas proinflamatorias, actividad incrementada de las metaloproteasas de la matrix (sobre todo la MMP2 y MMP9) y disminución de la enzima inhibidora de la metaloprotesa tisular 1 (TIMP1). La hipoxia, la necrosis tisular y las infecciones favorecen esta situación anormal, provocando un incremento de las enzimas proteolíticas y un déficit de los factores de crecimiento y de la fibrina con la consecuente destrucción de la matriz extracelular, lo que dificulta la curación normal de la úlcera. La cantidad de metaloproteasas se correlaciona con la duración y cronificación de una herida2,8,9.
Además, diversos estudios han demostrado un aumento de células senescentes en las úlceras crónicas, sobre todo fibroblastos2. Estas células dificultan la cicatrización de la úlcera, debido a que han perdido la capacidad de replicarse deteniendo su ciclo celular en G0 de forma irreversible.
Tratamiento convencional de la úlcera
El manejo terapéutico convencional para la curación de las úlceras crónicas se basa en dos ejes: el tratamiento de la enfermedad de base y la cura de la herida en sí misma. El objetivo principal es la preparación del lecho de la úlcera que favorece la creación del medio adecuado para su rápida cicatrización.
La European Wound Management Association (EWMA) describió los pasos a seguir para estimular la correcta cicatrización de la herida. Se recogen bajo el acrónimo TIME:
- T (tissue/tejido): limpieza y desbridamiento del tejido no viable.
- I (infection/infección): control de la infección.
- M (moisture/humedad): control del exudado favoreciendo un ambiente húmedo con la colocación del apósito bioactivo más adecuado según las características de la herida.
- E (edge/borde): estimulación y cuidados de los bordes de la herida.
No obstante, estos cuidados no aportan los factores de crecimiento, disminuidos en las úlceras que no responden adecuadamente al tratamiento2,8.
En 1986, Knighton et al demostraron que los factores plaquetarios autólogos aceleraban la epitelización del tejido de granulación hasta la completa cicatrización de las úlceras10. En los años 90, Anitua describió una técnica ambulatoria sencilla de obtención de PRP que facilitó que se extendiera su empleo de forma progresiva a diferentes campos de la medicina. Sin embargo, en pocas indicaciones hay estudios clínicos de suficiente entidad como para poder extraer conclusiones6.
Plasma rico en plaquetas (PRP)
Se define como aquel volumen de plasma autólogo que contiene una concentración de plaquetas más elevada que la basal (150.000 - 350.000/l). Aunque inicialmente se consideraba PRP al preparado plasmático cuya concentración de plaquetas era de 3 a 5 veces superior al nivel basal, actualmente se postula que es más importante la integridad plaquetaria que su concentración8,11. Cuando se hace referencia al PRP se engloban todas las fracciones que se pueden obtener en función del sistema de obtención utilizado13.
El PRP aporta una concentración elevada de moléculas bioactivas al lecho de la herida, activando de nuevo la migración, proliferación y diferenciación celular de monocitos, fibroblastos, células madre y osteoblastos. También estimula la angiogénesis y la activación de proteínas que favorecen la formación de la matriz extracelular12.
Para la obtención de PRP se centrifuga la sangre venosa del propio paciente (PRP autólogo) con el fin de conseguir capas de plasma con diferente contenido celular. Se extrae por pipeteo la fracción interesada y se activa con trombina y/o cloruro de calcio, para después ser aplicado, bien en forma de gel o bien inyectado.
Los objetivos de la revisión bibliográfica son: determinar el papel que juega el PRP, en base a las evidencias científicas existentes, en la curación de las úlceras crónicas de origen no diabético de las extremidades inferiores, sean vasculares, por presión, traumáticas, vasculíticas u otras causas; valorar la seguridad del proceso, y examinar su contribución a la mejora de la calidad de vida del paciente.
Material y método
Se realizó una revisión sistemática de artículos científicos y revisiones sistemáticas existentes sobre el tema seleccionado. Se consultó la base de datos MEDLINE (PubMed) de estudios originales utilizando las siguientes ecuaciones: prp AND ulcers chronics not diabetics; platelet rich plasma AND wound healing OR ulcers. El idioma de los estudios debía ser inglés o español. También se examinaron las revisiones sistemáticas en la Biblioteca Cochrane Plus, utilizando como palabras clave “plasma rico en plaquetas”, y se analizó la literatura contenida en Google Scholar en referencia a “plasma rico en plaquetas” y “úlceras crónicas”. Además, se analizaron las referencias de estos artículos seleccionados con el fin de rescatar otros estudios potencialmente incluibles para la revisión, que se encontraron en PubMed y en SciELO.
Criterios de inclusión
Se incluyeron estudios controlados y no controlados de pacientes mayores de 18 años portadores de úlceras crónicas, de una o varias etiologías, sin limitación en extensión o profundidad, tiempo de evolución ni tratamientos previos. Los resultados debían recoger datos, tanto sobre la curación completa como del porcentaje de reducción de la superficie ulcerada. Opcionalmente, también podían aportar información sobre efectos adversos acontecidos durante el tratamiento con PRP y/o cambios en la calidad de vida del paciente, bien de forma directa o indirecta.
Criterios de exclusión
En la primera revisión se excluyeron artículos que se referían en exclusiva a úlceras agudas de origen quirúrgico, quemaduras, tratamientos dentales o maxilofaciales, traumatológicos o de rejuvenecimiento facial. La segunda revisión descartó los trabajos que no cumplían con la extracción del PRP a través de la centrifugación del plasma, sino que empleaban lisados o preparados congelados. También se excluyeron los que hacían referencia únicamente a pie diabético.
Extracción de datos
Se localizaron en total 470 artículos tras la búsqueda inicial y se excluyeron los que estaban repetidos en las bases de datos utilizadas. Finalmente, se seleccionaron 3 revisiones sistemáticas, 12 estudios no controlados (ENC), 4 estudios controlados randomizados (ECR), 2 cartas al director y 4 artículos sobre descripción de un caso. Se leyeron los artículos completos con el fin de decidir si la información que contenían estaba relacionada con el objetivo del trabajo.
Análisis de datos
A fin de comparar la información obtenida, se estructuraron diversos subapartados en función del tipo de estudio, características de la úlcera, intervención realizada (obtención del PRP, forma de aplicación, protocolo de utilización) y resultados observados.
Resultados
1. Estudios clínicos no controlados (ENC)
De los 12 ENC no controlados, 9 incluían úlceras de diferentes etiologías. Sólo los de Salazar-Álvarez14, Sarvajnamurthy15 y Yilmaz16 tenían como objetivo de estudio de úlceras de insuficiencia venosa; aunque el tiempo de evolución medio y el área previa de la úlcera, antes del tratamiento con PRP, presentaban gran diversidad en los estudios. Además, los 21 protocolos no eran iguales.
Dos autores, Bernuzzi17 y Crovetti18, obtenían el PRP de sangre del paciente o bien de un donante, si el estado físico del paciente no era el adecuado. Cuatro investigadores utilizaban la técnica abierta para la creación del PRP, el resto usaron equipos comerciales. También difieren en el número de centrifugaciones necesarias para obtener el PRP, 7 de los autores optaron por una centrifugación única. Asimismo, la forma de aplicación también difería en cada estudio, aunque preferiblemente optaban por aplicar el PRP en gel o líquido directamente sobre el lecho de la úlcera; en ocasiones combinado con inyecciones de PRP en los bordes y/o en el nicho ulceroso14,15,19. La frecuencia de aplicación más habitual era semanal hasta conseguir la curación completa, aunque Suthar19 sólo hace una única aplicación al inicio del tratamiento y Salazar-Álvarez lo limita a 4 sesiones, aunque no hubiera conseguido la cicatrización total (Tabla I). Respecto a los resultados obtenidos en la curación de la úlcera, 10 estudios tenían como objetivo la curación completa, aunque sólo Salazar-Álvarez y Bernuzzi no lograron el 100% del objetivo. Todos los que midieron la reducción del área y volumen del lecho ulceroso, pudieron demostrar la mejoría de la evolución de la úlcera. Tres estudios hacen referencia a la disminución del dolor, contribuyendo a la mejoría en la calidad de vida, aunque sólo Salazar-Álvarez lo demuestra con la realización de la encuesta de calidad de vida SF‑12.

2. Estudios clínicos controlados
De 4 estudios, sólo uno incluía úlceras venosas exclusivamente, de los cuales Mazzucco20 evidenció una mejoría significativa en el uso del PRP respecto al grupo control. El resto de estudios, aunque observaron la reducción del tamaño de la úlcera, éste no fue significativo frente al grupo control. La única característica fue que todos emplearon PRP en forma de gel (Tabla I).
3. Revisiones sistemáticas y metaanálisis
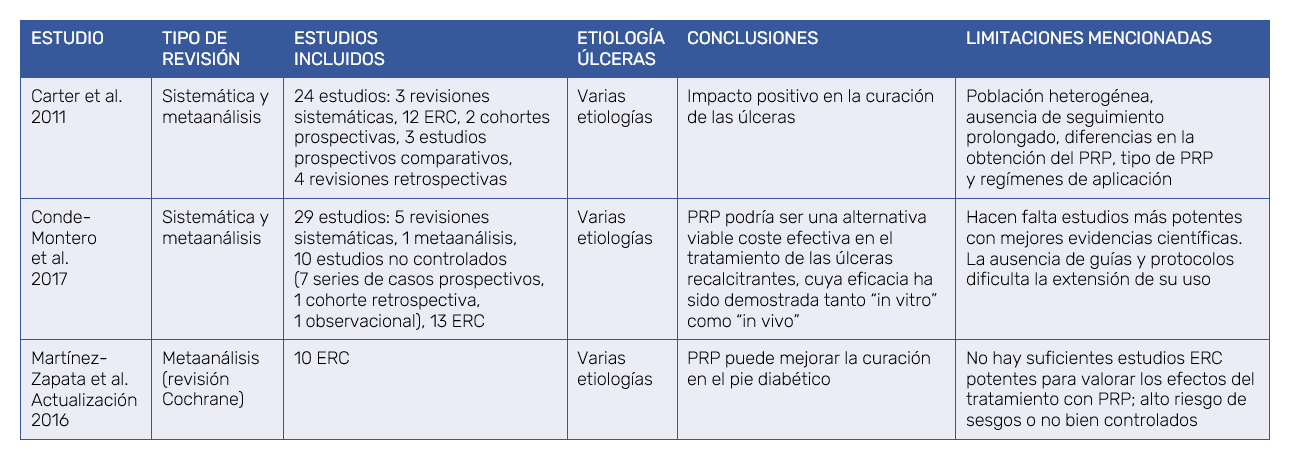
En 2011, Carter et al editaron una revisión de 21 artículos, de 2001 a 2011, sobre el tema21. Se seleccionaron 12 ERC y 9 ENC: estudios de cohortes, estudios comparativos (EC) y análisis retrospectivos. Podían incluir úlceras agudas o crónicas de cualquier etiología tratadas con PRP. El seguimiento mínimo de los estudios fue de 2 semanas y sus resultados ofrecían información sobre tamaño, profundidad, tiempo de resolución y complicaciones. Respecto a las úlceras, Carter informó que la curación completa era significativamente inferior en 2 ERC, y en otros dos estimó que el objetivo también se hubiera conseguido si el tiempo de seguimiento hubiera sido mayor. Un EC también mostró de forma consistente este resultado. Respecto al tiempo necesario hasta alcanzar la curación completa, cuantificado en semanas, 2 ERC y un estudio de cohortes mostraron una reducción significativa en el mismo. La reducción del área de la herida fue mayor en 2 ERC y en un EC, e igualmente la mejoría en la profundidad fue demostrada en un EC. Los efectos adversos fueron significativamente menores en todos los pacientes tratados con PRP.
En 2016, una actualización de la revisión Cochrane (Martínez-Zapata, 2012) que incluía 10 estudios ERC con 442 pacientes, comparaba el tratamiento con PRP en 228 de ellos frente a placebo o terapia estándar, que se aplicó a los otros 214 pacientes22. De los estudios, 4 incluían úlceras de etiología mixta, 3 de origen venoso y 3 correspondían a pie diabético. La duración promedio del tratamiento fue de 12 semanas. Las conclusiones del estudio fueron que el PRP mejoraba la cicatrización del pie diabético; sin embargo, los resultados fueron inciertos en las úlceras venosas o mixtas. No se encontraron evidencias estadísticamente significativas en el total del área epitelizada, porcentaje del área curada o tiempo transcurrido hasta la curación completa; tampoco en las complicaciones de las úlceras.
Conde-Montero et al (2017) publicaron una nueva revisión, incluyendo 10 ENC, 13 ECR y 5 revisiones sistemáticas (2 de ellas metaanálisis)9. Tras analizar y comparar los resultados de los 24 estudios, concluyeron que la eficacia del PRP en la cicatrización de las úlceras crónicas estaba relacionada con su etiología. Si la causa era venosa, los resultados sobre la evolución de las úlceras no eran concluyentes, y en caso de úlceras arteriales o por presión se requerirían estudios diseñados específicamente para ellas. La utilidad del PRP en el tratamiento del pie diabético es una evidencia científica; sus resultados siempre han mostrado mayor grado de mejoría que los del grupo control. Sin embargo, son menos evidentes en las úlceras de otras etiologías (Tabla II).
4. Estudios de casos
Se han incluido 6 artículos de series cortas, case reports, en los que se informa que el PRP ha mejorado la cicatrización de úlceras de larga evolución. Kanemaru (2014) informó de 2 casos con úlceras vasculíticas en pacientes con esclerosis sistémica, tratados con PRP autólogo obtenido por técnica cerrada y aplicado en forma de parche sobre el lecho de la herida tras la activación de las plaquetas con cloruro de calcio. Desde la primera aplicación semanal, se observó mejoría en el tejido de granulación y epitelización; al cabo de un mes el tamaño de las úlceras era menor que el conseguido con los tratamientos previos23. Kawakami (2015) describió un caso de úlcera por necrobiosis lipoidea tratado con una dosis mensual de PRP autólogo, observando una aceleración de la epitelización de la herida y disminución del dolor24. Pinto (2014) describe el caso de una mujer con úlceras de origen venoso de 13 años de evolución, sometida a diferentes tratamientos. Cuando se utilizó PRP en gel, se observó desde el principio un aumento del tejido de granulación con pequeños parches de epitelización superficial, y menos fibrosis en los bordes de la herida. Sin embargo, no se especificó ni el número ni la frecuencia de aplicaciones25. En la misma línea, Rodríguez-Zendejas (2014) describió el caso de una úlcera de 4 meses de evolución por mordedura de perro a la que se aplicó PRP autólogo en apósitos dos veces a la semana, consiguiéndose un ritmo de cicatrización de 8 mm/día (3,6 mm diarios se consiguieron con los tratamientos utilizados previos al PRP) y epitelización completa en 6 semanas26.
Cano-Trigueras (2017) presentó un caso de úlceras por insuficiencia venosa y linfedema de 24 años de evolución, que se trataron mediante desbridamiento quirúrgico y PRP autólogo, obtenido por técnica cerrada, consiguiendo una curación completa a los tres meses. No describe la frecuencia ni la forma de aplicación27. Por último, Kim (2012) informó sobre una úlcera traumática recalcitrante en una paciente encamada con pluripatología. En su tratamiento empleó PRP autólogo obtenido por técnica abierta, y aplicado directamente en el lecho de la herida hasta crear una fina película 2 veces a la semana durante 8 semanas. Primero se observó mejoría de la vascularización y aumento del tejido de granulación; a partir de la última dosis de PRP se inició la epitelización, que fue completa a los dos meses28.
Discusión
Es un hecho bien conocido que entre un 10 a un 20% de las úlceras se cronifican, pese a que tanto el diagnóstico como el tratamiento hayan sido los correctos1. Parecía lógico que, para subsanar el déficit de factores de crecimiento inherentes a los diferentes tipos de úlceras, se postulara la utilización de factores heterólogos. Sin embargo, la mayoría de estudios clínicos en estos casos muestran mejoría frente a placebo pero sin diferencias significativas. En clínica, sólo se ha utilizado el factor de crecimiento derivado de las plaquetas (PDGF) humano recombinante. Aunque posee estudios bien diseñados, que demuestran su efectividad en el tratamiento de las úlceras del pie diabético33 es poco demostrativa su relación coste-eficacia1.
El PRP se propone como terapéutica alternativa, capaz de aportar los factores de crecimiento necesarios para estimular de nuevo el crecimiento del tejido de granulación en una herida que no evoluciona adecuadamente. El PRP se obtiene de la centrifugación del plasma, una o varias veces según el investigador, y se realiza la activación posterior con trombina. De esta forma, la mayoría de las plaquetas permanecen íntegras8,11.
Sin embargo, cuando se han utilizado lisados plaquetarios, en diferentes estudios de los últimos años, los resultados obtenidos han sido decepcionantes; aunque aportan los factores de crecimiento, no consiguen incrementar las proteínas adhesivas y los mediadores lipídicos que activan la angiogénesis, y que deben aparecer tras la activación de las plaquetas29,30. Además, las investigaciones han demostrado que hasta concentraciones bajas de plaquetas íntegras aportan los niveles óptimos de factores de crecimiento necesarios para reactivar la cicatrización de la úlcera12,31‑34.
Tras la centrifugación del plasma sanguíneo se obtienen diferentes fracciones, con características celulares distintas como ya se ha comentado previamente. También hay controversia en este punto, no existiendo consenso entre los expertos en la composición ideal del PRP8. Unos autores defienden la utilización de la fracción leucocitaria del plasma (FLP), tanto por el potencial antibacteriano de los glóbulos blancos como por el efecto potenciador de la concentración de PDGF y TGF‑beta, algunas interleuquinas y metaloproteasas y la liberación de radicales libres que aportan los leucocitos35. Sin embargo, éstos también estimulan la acción de las colagenasas y las elastasas del tejido extracelular por lo que serían contraproducentes para la cicatrización y curación de las heridas por su potencial desencadenamiento de una respuesta inflamatoria11,36,37.
En los estudios “in vitro” se ha demostrado el efecto quimiotáctico del PRP. Bernuzzi (2010) pone de manifiesto la proliferación de diferentes familias celulares tras exponerlas durante 72 horas a concentraciones progresivas del derivado plaquetario. Además, ésta es dosis dependiente, consiguiendo una estimulación significativa a una concentración del 0,5% del PRP17. Sclafani (2015) hace una revisión de 13 artículos que recogen los resultados de estudios “in vitro” y que concluyen en el mismo sentido: la proliferación celular se produce y es concentración-dependiente8.
Hay diferencias sustanciales en la forma y frecuencia de aplicación del PRP y se carece de estudios comparativos al respecto. Conde-Montero et al (2017), indican que es imperativo que el tratamiento con PRP esté avalado por guías de práctica clínica que lo posicionen en el tratamiento de las úlceras de cada etiología9. La diversidad en la aplicación del PRP dificulta la comparación de estudios, el análisis de los resultados y la emisión de conclusiones claras y fiables. Por lo tanto, se debería protocolizar su empleo y, consecuentemente, la extensión de su uso8.
La aplicación de PRP en forma de gel ofrece buenos resultados, aunque la práctica asistencial se resiente por el consumo de tiempo extra necesario para su preparación. También cuenta el coste añadido cuando se emplean equipos comerciales, pues el PRP precisa mezclarse con polímeros bioactivos para obtener la debida consistencia gel para ser eficaz8,38.
Respecto a la seguridad del uso del PRP, en España la AEMPS sólo autoriza la utilización de plasma y trombina autólogos, para minimizar al máximo el riesgo de contagio de infecciones. En esta revisión, se presentan artículos con PRP obtenido de plasma homólogo donde quedan reflejadas todas las medidas de seguridad. En ninguno de ellos se notificó el diagnóstico de enfermedad infectocontagiosa alguna. Tampoco se recogieron diferencias significativas de aparición de efectos adversos entre los métodos tradicionales de cura de úlceras y el uso del derivado plaquetario.
La calidad de vida se evaluó en 3 estudios de esta revisión, 2 mediante test que indagaban directamente sobre la misma, y uno que valoraba la evolución del dolor, antes y después del tratamiento. Quian Yu (2017) utilizó la escala CIVIQ score sobre calidad de vida, que recoge 4 componentes: psicológico, físico, social y dolor38. Salazar-Álvarez (2014) empleó la encuesta SF‑12 dividida en dos vertientes, la física y la psíquica14. Romano documentó la eficacia del método mediante una escala visual analógica del dolor (EVA), tomando la referencia antes y después del tratamiento39. El resultado de los 3 fue positivo. Otros 5 estudios mencionan la mejoría del dolor experimentado en los pacientes sin haberlo cuantificado15,17‑20.
La reducción de la estancia hospitalaria también es una forma indirecta de evaluar la calidad de vida20 y en la literatura consultada hay estudios que constatan una disminución del uso de analgésicos intravenosos, según evolucionaba favorablemente la úlcera21.
Conclusiones
El PRP merece ser tenido en cuenta como una alternativa real en el tratamiento adyuvante de las úlceras crónicas. Su utilización, siguiendo las recomendaciones específicas de cada país, es segura.
Cabe señalar también la favorable relación coste-eficacia y su contribución a la mejoría de la calidad de vida de los pacientes.
Además, es preciso que el tratamiento con PRP esté avalado por guías con instrucciones claras de aplicación en la práctica clínica; lo que, sin duda, contribuirá a disminuir la variabilidad en los métodos de aplicación, su forma de obtención y mejor valoración de resultados.
No obstante, se necesitan nuevos estudios bien diseñados con muestras mayores de pacientes para corroborar los resultados inicialmente obtenidos.
Agradecimiento
La autora agradece al Dr. Justo M. Alcolea su contribución en la redacción junto a sus indicaciones y correcciones de estilo, durante la fase de puesta a punto y finalización de este artículo.
Conflicto de intereses
No se declara ningún conflicto de intereses.
Bibliografía
- Conde-Montero E, Fernández Santos ME, Suárez Fernández R. Platelet-rich plasma: Applications in Dermatology. Actas Dermatosifiliogr. 2015; 106:104‑11. https://doi.org/10.1016/j.ad.2013.12.021
- Velasco M. Aspectos diagnósticos y terapéuticos de las úlceras de las piernas. Actas Dermatosifiliogr. 2011; 102(10):780‑90. https://doi.org/10.1016/j.ad.2011.05.005
- Suresh DH, Suryanarayan S, Sarvainamurthy S, Puvvadi S. Treatment of a Non‑healing diabetic foot ulcer with platelet rich plasma. J Cutan Aesthet Surg. 2014;7(4):229‑31. https://doi.org/10.4103/0974-2077.150786
- Schreml S, Szeimies RM, Prantl L, Landthaler M, Babilas P. Wound healing in the 21st century. J Am Acad Dermatol. 2010; 63:866‑8. https://doi.org/10.1016/j.jaad.2009.10.048
- Rueda J, Torra JE, Martínez F, Verdú J, Soldevilla JJ, Roche E et al. Primer estudio nacional de prevalencia de úlceras de pierna en España. Gerokomos. 2004; 15:230‑47.
- Conde-Montero E, Horcajada-Reales C, Suárez-Fernández R. Utilidad de plasma rico en plaquetas en el tratamiento de las úlceras crónicas de la piel. Piel. 2014; 29:248‑54. https://doi.org/10.1016/j.piel.2013.10.007
- Pflege PA, Wienert JR. Venous ulcer: results of study over home care. Phlebologie. 2002; 3:67‑71.
- Conde-Montero E. Validación de un nuevo método de obtención de plasma rico en plaquetas para su aplicación en úlceras cutáneas crónicas.Tesis doctoral. Madrid: Universidad Complutense de Madrid; 2016.
- Conde-Montero E, Cueva de la P y Martínez-González JM. Platelet rich plasma for the treatment of chronich wounds: evidence to date. Chronic Wound Care Manegement. 2017; 4:107‑20. https://doi.org/10.2147/CWCMR.S118655
- Knighton DR, Doucette M, Fiegel VD, Ciresi K, Butler E, Austin L. The use of platelet derived wound healing formula in human clinical trials. Prog Clin Biol Res. 1988; 266:319‑29.
- Anitua E. Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants. 1999; 14(4):529‑35.
- Anitua E, Andia I, Ardanza B, Nurden P, Nuerden AT. Autologous platelets as source of proteins for healing and tissue regenaration. Thromb Haemost. 2004; 91:4‑15. https://doi.org/10.1160/th03-07-0440
- Informe/V1/23052013. Informe de la Agencia Española de Medicamentos y Productos Sanitarios sobre el uso de plasma rico en plaquetas, publicado el 23 de mayo de 2013.
- Salazar-Álvarez AE, Riera-del-Moral LF, García-Arranz M, et al. Uso de plasma rico en plaquetas para cicatrización de úlceras crónicas de miembros inferiores. Actas Dermosifiliogr. 2014;105:597‑604. https://doi.org/10.1016/j.ad.2013.12.011
- Sarvajnamurthy S, Suryanarayan S, Budamakuntala L, Suresh DH. Autologous platelet rich plasma in chronic venous ulcers: study of 17 cases. J Cutan Aestht Surg. 2013; 6(2):97‑9. https://doi.org/10.4103/0974-2077.112671
- Yilmaz S, Aksoy E, Doganci S, et al. Autologous platelet-rich plasma in treatment of chronic venous leg ulcers: a prospective case series. Vascular. 2015; 23(6):580‑5. https://doi.org/10.1177/1708538114563824
- Bernuzzi G, Tardito S, Bussolati O, et al. Platelet gel in the treatment of cutaneous ulcers: the experience of the Immunohaematology and Transfusion Centre of Parma. Blood Transfus. 2010; 8(4):237‑47. https://doi.org/10.2450/2009.0118-09
- Crovetti G, Martinelli G, Issi M, et al. Platelet gel for healing cutaneous chronic wounds. Transfus Apher Sci. 2004; 30(2):145‑51. https://doi.org/10.1016/j.transci.2004.01.004
- Suthar M, Gupta S, Bukhari S, Ponemone V. Treatment of chronic non healing ulcers using autologous platelet rich plasma: a case series. J Biomed Sci. 2017; 24(1):16. https://doi.org/10.1186/s12929-017-0324-1
- Mazzucco L, Medici D, Serra M, et al. The use of autologous platelet gel to treat difficult-to-heal wounds: a pilot study. Transfusion. 2004; 44(7):1013‑8. https://doi.org/10.1111/j.1537-2995.2004.03366.x
- Carter MJ, Fylling CP, Parnell LK. Use of platelet rich plasma gel on wound healing: a systematic review and meta-analysis. J Plast Surg. 2011; 11:382‑410.
- Martínez Zapata MJ, Martí-Carvajal AJ, Solá I, Expósito JA, Bolíbar I, Rodríguez L, Zaror C. Autologous platelet-rich plasma for treating chronic wounds. Cochrane Database of Systematic Reviews 2016, Issue 5. Art No: CD006899. https://doi.org/10.1002/14651858.cd006899.pub3
- Kanemaru H, Kajihara I, Yamanaka K et al. Platelet-rich plasma therapy is effective for the treatment of refractory skin ulcers in patients with systemic sclerosis. Mod Reumatol. 2015; 25(4):660‑1. https://doi.org/10.3109/14397595.2014.924204
- Kawakami T et al. Therapeutic effect of autologous platelet-rich plasma (PRP) on recalcitrant cutaneous ulcers in livedoid vasculopathy. JAAD Case Rep. 2015; 1(5):310‑1. https://doi.org/10.1016/j.jdcr.2015.07.005
- Pinto JM, Pizani N, Kang HC, Knecht LA. Application of platelet-rich plasma in the treatment of chronic skin ulcer - case report. An Bras Dermatol. 2014; 89(4):638‑40. https://doi.org/10.1590/abd1806-4841.20143004
- Rodríguez-Zendejas N, Contreras Ruiz J, Garrido-Espíndola X, Romero- Valdovinos M, Lozano-Plotanoff A. Uso de plasma autólogo rico en plaquetas en úlceras de difícil cicatrización. Reporte de un caso. Med Cutan Iber Lat Am. 2014; 42(1‑3):62‑4.
- Cano-Trigueros E, Díaz-Serrano R. Tratamiento de úlcera vascular de 24 años de evolución con plasma rico en factores de crecimiento. Rev Chil Cir. 2017; 69(5):355‑6. https://doi.org/10.1016/j.rchic.2017.02.002
- Kim DH, Kim JY, Seo SH, Ahn HH, Kye YC, Choi JE. Recalcitrant cutaneous ulcer of comorbid patient treated with plateled rich plasma: a case report. J Korean Med Sci. 2012; 27:1604‑6. https://doi.org/10.3346/jkms.2012.27.12.1604
- Steed DL. Clinical evaluation of recombinant human platelet-derived growth factor for the treatment of lower extremity ulcers. Plast Reconstr Surg. 2006;117(7 Suppl):143S-151S. https://doi.org/10.1097/01.prs.0000222526.21512.4c
- Senet P, Bon FX, Benbunan M, Bussel A, Traineau R, Calvo F, et al. Randomized trial and local biological effect of autologous platelets used as adjuvant therapy for chronic venous leg ulcers. J Vasc Surg. 2003; 38(6):1342‑8. https://doi.org/10.1016/s0741-5214(03)00908-x
- Anitua E, Andia I, Sánchez M. PRGF (Plasma Rico en Factores de Crecimiento). Dental dialogue. 2004; 3(1):2‑15.
- Weibrich G, Kleis WKG, Hafner G, Hitzler WE, Wagner W. Comparison of platelet, leukocyte, and growth factor levels in point-of-care platelet-enriched plasma, prepared using a modified curasan kit, with preparations received from a local blood bank. Clin Oral Implants Res. 2003; 14(3):357‑62. https://doi.org/10.1034/j.1600-0501.2003.00810.x
- Mazzucco L, Balbo V, Cattana E, Guaschino R, Borsini P. Not every PRP gel is born equal. Evaluation of growth factor availability for tissues through four PRP‑gel preparations: Fibrinet, RgenPRP‑kit, Plateltex and one manual procedure. Vox Sang. 2009; 972(2):110‑8. https://doi.org/10.1111/j.1423-0410.2009.01188.x
- Lorente Pérez-Sierra A. Estudio de microscopía electrónica y cuantificación de los factores de crecimiento mediante un nuevo procedimiento de obtención de plasma rico en plaquetas. Tesis doctoral. Universidad Complutense de Madrid. 2010.
- Zimmermann R, Jakubietz R, Jakubietz M, Strasser E, Schlegel A, Wiltfang J, Eckstein R. Different preparation methods to obtain platelet components as a source of growth factors for local application. Transfusion. 2001; 41(10):1217‑24. https://doi.org/10.1046/j.1537-2995.2001.41101217.x
- Appel TR, Pötzsch B, Müller J, von Lindern J, Bergé ST, Reich RH. Comparison of three different preparations of platelet concentrates for growth factor enrichment. Clin Oral Impl Res. 2002; 13:522‑8. https://doi.org/10.1034/j.1600-0501.2002.130512.x
- Anitua E. Protocolo de obtención y evaluación clínica e histológica de plasma rico en factores de crecimiento para la preparación de áreas futuras en implantología. Estudio con SEM y evaluación clínica e histológica. Tesis Doctoral, Valencia 2002.
- Yu Q, Han F-J, LV S de. To comparate the healing of pressure sores by the use of combination therapy with platelet rich plasma and gelatin hidrogel versus platelet rich plasma and collagen. Biomed Res‑Ind. 2017; 28(3):1216‑22.
- Romano F, Paolino FM, Rizzo BA, et al. The use of growth factors, CD34(+) cells and fibrin for the management of chronic venous ulcers. Int Wound J. 2016; 13(5):1011‑3. https://doi.org/10.1111/iwj.12500

