Hiperpigmentación postesclerosis química o fotónica. Estudio clínico retrospectivo y revisión de la literatura
en esta revista durante el año 2022
Introducción
La escleroterapia química es un procedimiento médico que consiste en inyectar sustancias químicas, denominadas esclerosantes, con la finalidad de destruir el endotelio de la vena exponiendo el colágeno y provocando un venoespasmo con formación de un cordón fibroso, que se conoce como esclerosis. La posterior reabsorción del cordón hace que el resultado funcional sea el equivalente a la exéresis quirúrgica de la vena1,2. En un porcentaje no despreciable de pacientes que se someten a escleroterapia la trombosis química, que da origen al esclerus, es responsable de algunos efectos adversos, como la hiperpigmentación postesclerosis (HPE) que, junto con el matting, son las complicaciones menores más frecuentes3‑5.
Se define la HPE como la pigmentación cutánea que aparece sobre el trayecto del vaso tratado tras la escleroterapia. Se habla de HPE persistente cuando la mancha marrón todavía está presente después de un año1. La HPE tiene una incidencia variable que en la literatura varía considerablemente, desde el 0,3 al 30% a las 3 o 4 semanas del tratamiento y aunque irritante, especialmente en aquellos casos en los que la estética es uno de los objetivos del mismo, no suele ser causa de abandono del tratamiento. En el 70% de los casos se resuelve antes de los 6 meses, aunque puede persistir más allá del año en el 10% de los pacientes1,5,6.
El mecanismo exacto responsable de la HPE no es bien conocido. Histológicamente se ha visto que la HPE ocurre de 6 a 12 semanas tras el tratamiento esclerosante, independientemente del producto empleado, polidocanol (POL), tetradecil sulfato de sodio (TDS) o solución salina hipertónica. El depósito de hemosiderina en la dermis se considera como responsable de la pigmentación. Suele encontrarse de 0,2 a 2,8 mm desde la capa granular, con melanocitos normales a lo largo de la unión dermo-epidérmica. Dicha hemosiderina se produciría como consecuencia de la degradación de la hemoglobina de los hematíes del trombo que, de forma inevitable, se forma tras la punción venosa. La inflamación provocada en el endotelio venoso activa los macrófagos tisulares, que captarán estos depósitos de hemosiderina determinando la pigmentación marrón-dorada a nivel de la dermis superficial7.
La participación de la melanina en la HPE es más probable en fototipos de piel III y IV de la clasificación de Fitzpatrick. Esta hiperpigmentación postinflamatoria es una pigmentación melánica que se produce tras cualquier agresión cutánea: arañazo, cicatriz, quemadura o una pequeña erosión; la melanina es atrapada por macrófagos dérmicos superficiales. También se ha detectado que algunos pacientes, con defectos en los mecanismos de almacenamiento y/o transporte del hierro, tienen más riesgo de desarrollar HPE; aunque hay discordancias entre los estudios que señalan una relación entre elevados niveles de ferritina en plasma y mayor predisposición a hiperpigmentar8,9. En cualquier caso, hay acuerdo en que para disminuir el riesgo de desarrollar HPE es preciso evitar la extravasación hemática tras la inyección del esclerosante, que se produciría por diapédesis de los hematíes tras la necrosis endotelial, siendo favorecido su paso a través de la media y de la adventicia cuando la inflamación subsiguiente las alcanza1,10.
Los esclerosantes detergentes (POL y TDS) actúan por detersión de la superficie lipídica de la membrana de las células endoteliales. El daño endotelial ocurre de forma rápida, a los pocos minutos de su administración, y puede extenderse hacia las capas media y adventicia en virtud de la concentración del esclerosante empleado que, a su vez, es determinante en la aparición de HPE1,5,10. Es recomendable ajustar la concentración al diámetro del vaso a tratar, aunque no hay diferencias significativas en cuanto a HPE entre la utilización de esclerosante líquido o en forma de MPOL11,12.
La glicerina cromada es el representante de los denominados esclerosantes irritantes. Actúa sobre las células endoteliales provocando la desnaturalización de las proteínas. Es un esclerosante débil y su indicación principal sería la eliminación de telangiectasias azules y rojas que no estén sometidas a una sobrecarga de presión por parte de venas nutricias. En su favor juega que tiene poca capacidad de pigmentar la piel suprayacente13‑16. Sin embargo, no será objeto del presente estudio, en el que se considerará únicamente la MPOL, ya que los vasos objeto de tratamiento son varices reticulares y tronculares.
Con el fin de minimizar y prevenir la HPE es preciso realizar una historia clínica completa que permita detectar factores de riesgo como la hipercoagulabilidad; evaluar la toma de fármacos, como la minociclina, que podría inducir una hiperpigmentación azulada casi permanente17, así como la práctica de tratamientos estéticos concomitantes: fotodepilación, eliminación de tatuajes, o tratamiento de cicatrices entre otros. Igualmente, es importante llevar a cabo un diagnóstico ecográfico exhaustivo, conocer bien la técnica esclerosante y sus posibles complicaciones, ajustarse a un protocolo adecuado de tratamiento y seguir la evolución de cada paciente; lo que permitirá actuar de forma precoz una vez reconocida la complicación18,19. De igual manera, es preciso informar debidamente al paciente, a fin de que conozca esta complicación, se implique y tenga una correcta adherencia al tratamiento postescleroterapia.
La prevención y el seguimiento son esenciales, ya que una vez aparece la HPE, se ha de actuar sin dilación, antes de que la pigmentación se convierta en persistente lo que, sin duda, ensombrecería el pronóstico. La hidroquinona suele emplearse en forma de cremas combinadas con ácido retinoico, para facilitar su tránsito a través de la epidermis hasta alcanzar la capa basal y la dermis superficial1,6. También puede emplearse un quelante del hierro, como la deferoxamina. Su formulación debe realizarse añadiendo agentes nanosomados, ya que por vía tópica es de difícil absorción. Algunos autores refieren que su eficacia es discreta o, en muchos casos, nula. Clásicamente, se ha propuesto como alternativa el empleo de deferoxamina en mesoterapia como alternativa para atravesar la barrera dermo-epidérmica, aunque no hay estudios que avalen su eficacia15,20.
Se ha descrito que el empleo de diversos agentes exfoliantes podría acelerar el proceso de despigmentación; aun así, los resultados no son fácilmente reproducibles. Se han utilizado diversos ácidos: tricloroacético (TCA), mercaptoacético y retinoico. Su aplicación debe realizarse con prudencia, valorando las asociaciones y concentraciones a emplear para evitar ocasionar irritaciones cutáneas, aparte de hipo o hiperpigmentaciones postinflamatorias secundarias a su empleo.
La TC también ha sido recomendada tras el tratamiento postescleroterapia. Su acción beneficiosa se debería a la disminución de la hipertensión venosa, al efecto antiinflamatorio y a la prevención de la formación del trombo. Aun así, los estudios presentados son diversos y sin conclusiones definitivas20.
La HPE puede ocurrir en cualquier parte de la pierna, aunque se ha notificado que su frecuencia aumenta en los vasos situados en la vecindad de la rodilla o en el tobillo. Esto podría ser debido a una mayor fragilidad capilar, secundaria a una presión intravascular mayor por efectos gravitacionales o por presencia de perforantes incompetentes.
En relación a lo expuesto, el objetivo del presente trabajo es analizar retrospectiva y comparativamente la incidencia de HPE en pacientes tratados en los últimos 20 años con MPOL o microespuma más láser de Nd:YAG de pulso largo y emisión en 1064 nm. Además, se analiza la evidencia científica disponible sobre las pautas de prevención y el tratamiento de la HPE.
Material y método
Se revisaron 1.219 historias clínicas de pacientes, que cumplían con los criterios de inclusión / exclusión que se mencionarán, con la finalidad de evaluar la incidencia y tiempo de resolución de la HPE. Todos los pacientes se trataron en Clínica Alcolea (Hospitalet de Llobregat, Barcelona). Para el estudio comparativo los pacientes se dividieron en 2 grupos. En el grupo A se incluyeron 438 pacientes tratados con MPOL, de enero de 2001 a enero de 2012. Del grupo B formaron parte 781 pacientes tratados con MPOL primero e inmediatamente después con un láser de Nd:YAG de pulso largo que emite en 1064 nm, desde febrero de 2012 hasta mayo de 2021. La técnica de preparación e inyección de la microespuma fue idéntica en ambos grupos, ya que el protocolo de tratamiento está bien establecido.

Se consideraron los siguientes criterios de inclusión:
- Mujeres con rango de edad de 45 a 65 años. Aunque se trataron pacientes por encima y debajo de los límites señalados, se decidió no incluirlos en el estudio para no aumentar la dispersión de la muestra. Las características de la muestra se resumen en la Tabla I.
- Competencia de los confluentes safeno-femorales y safeno-poplíteos en todos los pacientes de ambos grupos según examen ecográfico realizado.
- Pacientes que estuvieran incluidos en los estadios CEAP 1 y 2.
- Pacientes que no hubieran recibido tratamiento esclerosante en los 12 meses anteriores.
- Acudir a las consultas de control de 2 semanas, 3, 6 y 12 meses después del tratamiento, independientemente de que la técnica se hubiera realizado solo con POL o POL más láser de Nd:YAG.
- Entender, aceptar y firmar el consentimiento informado específico.
Los criterios de exclusión fueron:
- Pacientes varones.
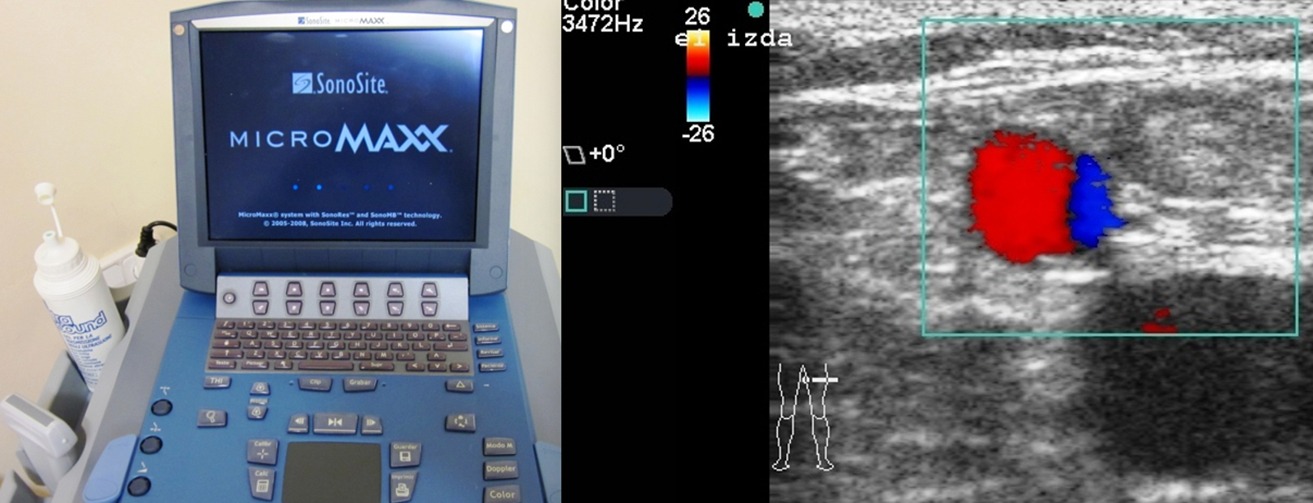
- Diagnóstico ecográfico de insuficiencia de troncos safenos: mayores o menores (Figura 1).
- Tratados en los 12 meses previos o que provinieran de otros centros.
- HPE persistente, aunque se hubieran tratado con anterioridad a 12 meses.
A todas las pacientes del grupo A se les prescribieron idénticas pautas de tratamiento por vía oral, un flebotónico con troxerrutina y extracto 5:1 de Ruscus aculeatus para tomar 2 veces al día; por vía tópica, una crema con hesperidina y extracto de Arnica montana; como terapia compresiva, Mediven Struva® 35 (Medi Bayreuth España, Hospitalet de Llobregat, Barcelona), con indicación de llevarlas durante 6 días de mañana a noche, diferenciando que las pacientes tratadas de varices tronculares y reticulares, con diámetro superior a 3 mm, debían mantener la media también durante la noche las primeras 3 noches, mientras que las tratadas de reticulares, inferiores a 3 mm, solo la mantenían la primera noche. Idénticas recomendaciones se hicieron para los pacientes del grupo B, a fin de evitar sesgos.
A todas las pacientes se les practicó esclerustomía de forma sistemática si la precisaron, sin importar la localización o la extensión de los esclerus, en la segunda semana posterior a cada sesión de tratamiento.
Tipo de esclerosante y técnica
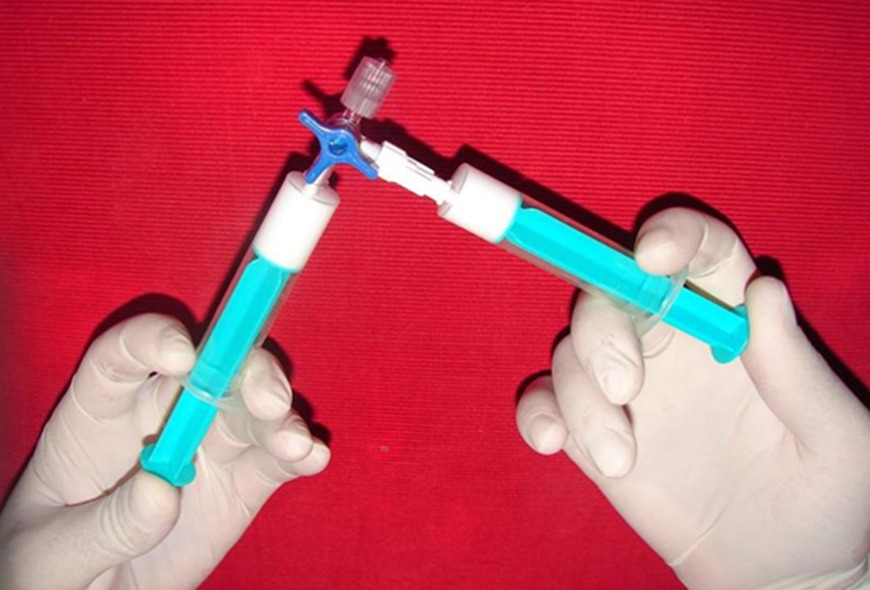
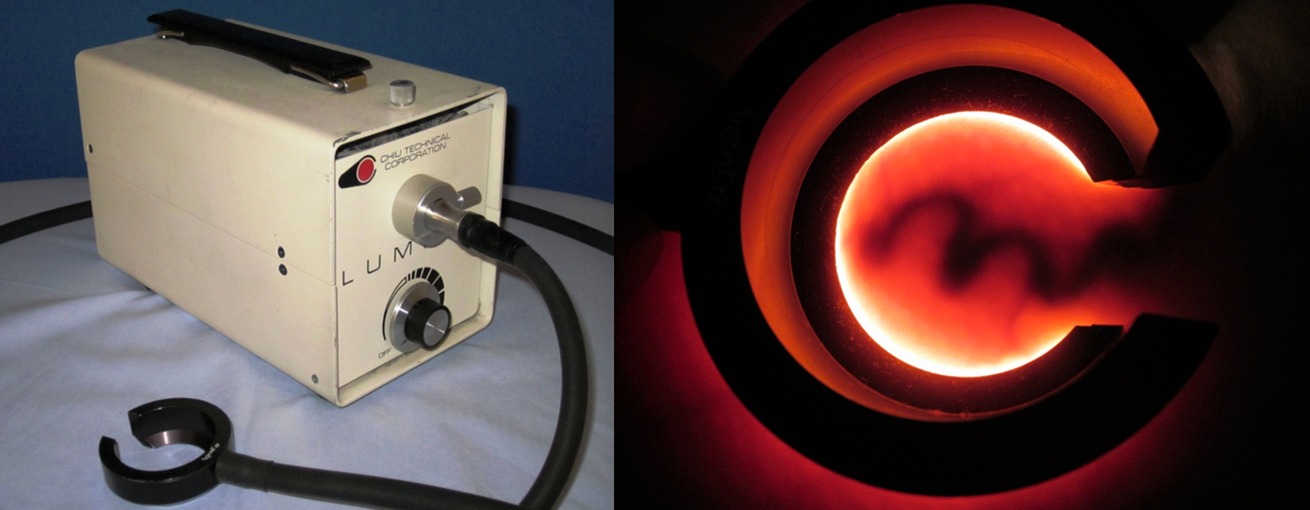
En ambos grupos se empleó el mismo esclerosante, POL (Etoxiesclerol®, Ferrer Farma, Barcelona) en forma de microespuma, ajustando la concentración y dosis al diámetro del vaso. La microespuma se preparó según el método de Tessari21, aunque modificado, interponiendo un microfiltro de 5 micras (Sterifix® PURY 5 micras, Braun España, Barcelona) entre la llave de 3 vías y una de las jeringas (Figura 2). Las inyecciones se realizaron intravasculares con ayuda de un transiluminador (Lumina, CHIU Corp. NY, USA) (Figura 3).

Sistema láser
Los pacientes del grupo B fueron tratados inmediatamente después de inyectarles POL en microespuma con un láser de Nd:YAG de pulso largo, emisión en 1064 nm y tasa de repetición de 6 Hz (Figura 4).
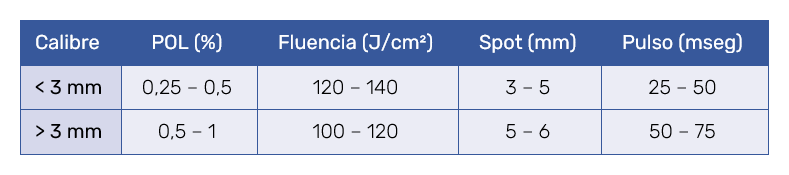
La fluencia, el tiempo de pulso y el tamaño del spot se ajustaron en relación al diámetro del vaso tratado (Tabla II). No obstante, es preciso señalar que el tratamiento combinado permite ajustar la dosimetría empleando fluencias más bajas.
Análisis estadístico
Al tratarse de 2 grupos que diferían en número se aplicó la metodología de Cohen (Tabla III) para que la potencia de las pruebas aplicadas fuera la correcta22.

El estudio estadístico se realizó con el programa SPSS v.21 para Windows. Se aplicaron las pruebas t de Student para muestras independientes y Ⲭ² de Pearson o test de independencia de variables. Se tomó p = 0,05 como punto de significación.
Revisión sistemática
Con objeto de contrastar los resultados de nuestro estudio con lo publicado en la literatura, adicionalmente se realizó una revisión sistemática de artículos publicados sobre prevención y tratamiento de la HPE, desde 1 de enero de 2000 hasta 31 de octubre de 2021.
La estrategia de la búsqueda se realizó en las siguientes bases de datos: Medline (PubMed), Embase, UpToDate, Cochrane, Scopus, ScienceDirect, SciELO, Cinhal Complete y Latindex. Las palabras clave utilizadas fueron: sclerotherapy, hyperpigmentation, pigmentation, prevention, treatment, compression therapy, laser, peeling, depigmentation, depigmenting. Tras la obtención inicial de artículos se depuró la búsqueda; eliminando aquellos que incluían pigmentación distinta de la HPE, o su etiología no era postescleroterapia; no se pudo disponer del resumen y/o del texto completo; eran duplicados o existía indefinición del término HPE. Por último, se procedió al rescate de artículos, extendiendo la búsqueda a la bibliografía de los seleccionados. Se excluyeron revisiones sistemáticas, salvo a efectos de la discusión. Tras aplicar los criterios de selección se incluyeron 32 artículos.
Resultados
Se procederá de la misma manera en la evaluación de resultados; por una parte se analizarán los datos clínicos del estudio retrospectivo y, por otra, la evidencia de la revisión sistemática.
Resultados clínicos
En el grupo A, que incluyó a 438 pacientes, la incidencia de HPE fue del 11% de los tratados en el control efectuado a las 2 semanas, resultando afectados 48 pacientes; a los 3 meses, la incidencia decreció hasta el 7% (31 pacientes), a pesar de que en el segundo control se detectaron 3 pacientes más con HPE que no la presentaban en el primer control. A los 6 meses la incidencia de HPE descendió hasta situarse en el 3% (13 pacientes). En el último control, realizado 12 meses después de la última sesión de escleroterapia, ningún paciente presentaba HPE.
En el grupo B, que incluía 781 pacientes, la HPE estaba presente en 39 pacientes (7%) en el control de la segunda semana. Igual que en el grupo anterior, descendió a 31 pacientes (4%), incluyendo 2 pacientes que no la tenían en el anterior control. En el control de los 6 meses, la HPE persistía en 8 pacientes (1%), desapareciendo en el último control al año (Tabla IV).
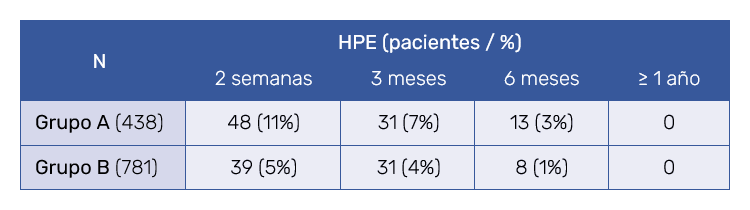
Tanto en el grupo A como en el B, la mayor disminución de HPE se produjo entre el control del tercero al sexto mes. No obstante, en todos los controles la disminución fue estadísticamente significativa con p‑valores < 0,05. Lo mismo cabe decir cuando se efectúa la comparación global de la presentación de la HPE en cada grupo y en cada uno de los controles efectuados (Figura 5).
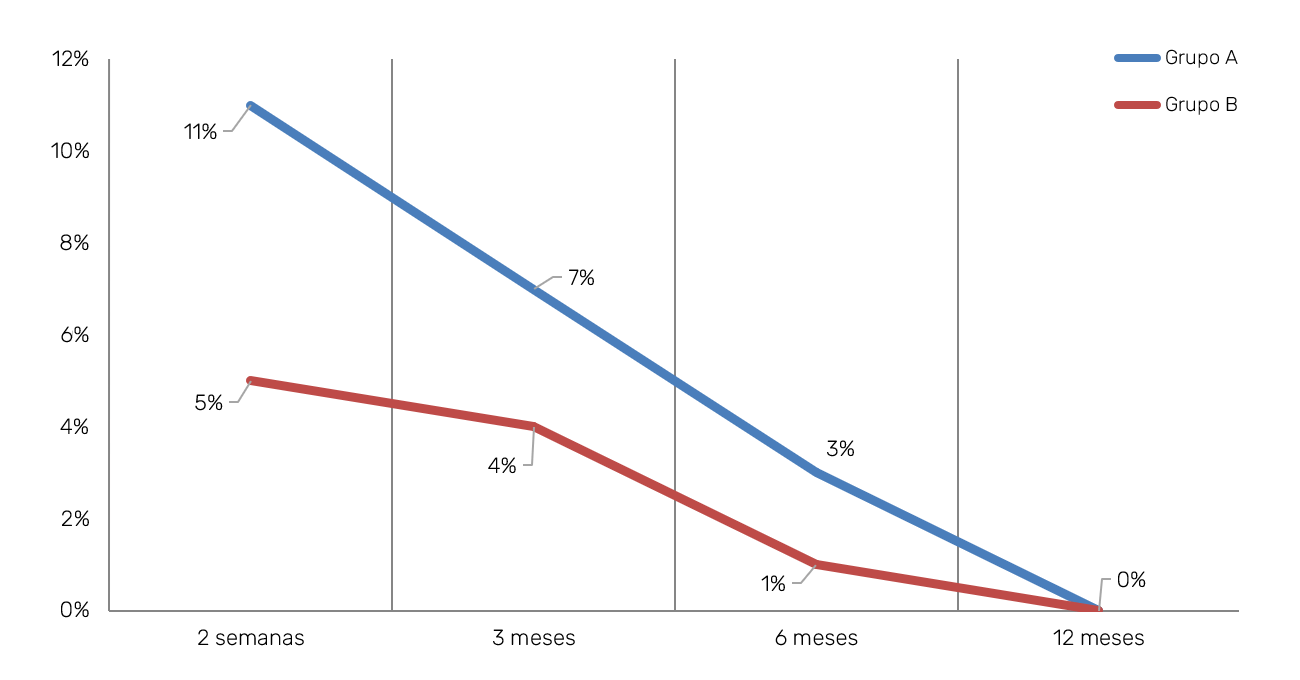
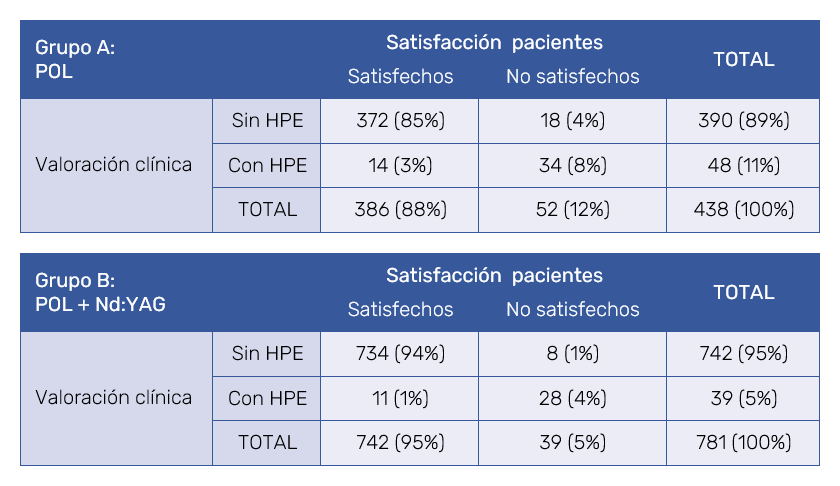
En los historiales seleccionados se había cumplimentado la satisfacción de las pacientes con los resultados obtenidos. Para comparar la valoración clínica con la satisfacción alcanzada en cada grupo se elaboraron las pertinentes tablas cruzadas, mostrando que, en el grupo A (pacientes tratadas solo con microespuma de POL) como en el B (pacientes con tratamiento combinado), hubo pacientes insatisfechas, aunque no presentaron la complicación de la HPE, lo que fue significativamente mayor en el grupo A respecto al B (Tablas V y VI). Cabe señalar que, a pesar de la insatisfacción producida por la HPE, no hubo abandono del tratamiento por parte de ninguna paciente.
Revisión sistemática
Tras la consulta de las bases de datos antemencionadas se obtuvieron 676 artículos. Tras aplicar los criterios de inclusión/exclusión y eliminar los duplicados se identificaron 32 estudios, 29 sobre prevención y 3 de tratamiento de la HPE. De todas las recomendaciones de los artículos sobre prevención, la eliminación del coágulo, de 2 a 3 semanas después de cada sesión de esclerosis, está incluida en las guías europeas con evidencia 1C. La terapia compresiva (TC) postescleroterapia parece ser beneficiosa, especialmente en C1, aunque no hay evidencia suficiente en cuanto al tipo, grado y/o duración de la misma. Respecto a la farmacología, sulodexida podría ser de utilidad para prevenir la HPE. De los 3 trabajos centrados en el tratamiento de la HPE; uno, estudia la aplicación de deferoxamina perilesional; los otros 2, el empleo de láseres de colorante pulsado y Q‑switched, respectivamente.
Discusión
La HPE es una complicación frecuente cuyo tratamiento y resolución no es fácil según señalan diferentes autores, siendo la mejor estrategia su prevención1,23. En la literatura hay coincidencia en señalar como determinante en la prevención de la HPE, el apropiado conocimiento sobre la técnica y el esclerosante a emplear, así como su concentración en relación al diámetro del vaso y a las condiciones hemodinámicas concurrentes24, volumen empleado y velocidad de la inyección25‑27. También debe tenerse en cuenta la localización de las varices tratadas; la HPE es más frecuente cuando el vaso tratado es muy superficial, con calibre de 1‑2 mm y de color azulado23‑27.
No obstante, el factor decisivo en la aparición de la HPE es la formación del trombo o esclerus. Se ha invocado en su formación la inflamación secundaria a la acción del esclerosante, mayor si se emplea una concentración superior a la necesaria para inducir el cierre del vaso, independientemente de que la preparación sea en líquido o en microespuma28,29. Aunque cabe tener en cuenta que, si se emplea el POL a baja concentración, como han demostrado estudios de tromboelastografía in vitro, puede ser un estímulo para la formación de coágulos fuertes30.
Cuando el esclerosante induce la formación del trombo químico (esclerus) se produce un fenómeno inflamatorio sobre el endotelio que puede ser extensivo al resto del vaso. Es fácil entenderlo cuando se inyecta el esclerosante en concentración elevada; sin embargo, muchos profesionales esclerosan con concentraciones bajas en la creencia de que puede minimizarse la aparición de efectos adversos, entre ellos la HPE. Es sabido que tras la inyección se produce un vasoespasmo, del que se recupera en mayor o menor medida transcurrido un tiempo, permitiendo que haya de nuevo reentrada de las tributarias vecinas que no han sufrido la acción del esclerosante. También se ha comprobado in vitro que el POL, a concentraciones de 3,5 mg/ml (0,35%) o superiores, estimula a los macrófagos con la consiguiente liberación de interferón‑γ TNF‑α30. No está claro que la fagocitosis de hemosiderina induzca la apoptosis de esta estirpe celular provocando un efecto tatuaje in situ1,31. Tampoco que la melanina sea responsable de la HPE, aunque podría contribuir si el proceso inflamatorio postesclerosis alcanzara el límite dermo-epidérmico, fenómeno posible cuando las varices esclerosadas son superficiales1,18.
En lo que hay consenso es que la punción y evacuación del esclerus (trombectomía) llevada a cabo entre la primera y la tercera semana reduce significativamente la HPE32. En nuestro estudio, y en coincidencia con la literatura, la evacuación del esclerus generalmente en la segunda semana ha sido determinante para minimizar la aparición de HPE, contribuyendo a que su persistencia en el tiempo decayera de forma rápida, pasando en el grupo A del 11% de los casos hasta el 3% a los 6 meses. En el grupo B se produjo una disminución del 5% inicial hasta el 1% a los 6 meses. Es destacable que ningún paciente presentó HPE tras terminar el control de un año posterior al tratamiento, por lo que no observamos ningún caso de HPE persistente.
Cuando se comparan los resultados entre ambos grupos: A, tratados solo con MPOL, y B, tratados con MPOL y láser de Nd:YAG, se observa una diferencia estadísticamente significativa (p < 0,05) en la observación de HPE. Esta diferencia, de un 55% menos de HPE, la atribuimos a la posterior acción del láser sobre el vaso previamente tratado con MPOL33. Anteriores trabajos ya habían confirmado que la sinergia microespuma-láser contribuía de modo altamente eficaz a obtener mejores y más rápidos resultados, con disminución de efectos adversos en la eliminación de varices, incluso a largo plazo34‑36. La sinergia MPOL-láser de Nd:YAG en emisión de 1064 nm es bien conocida y se apoya en los siguientes hechos: el efecto de resonancia entre el etanol y la emisión láser en esa longitud de onda; el pico de absorción de 250 nm del propio POL se corresponde con la absorción no lineal de 4 fotones (transición de 1064 / 4 = 266 nm), y el incremento de la absorción fotónica debido al scattering sobre la microespuma (ley de Eaton-Lambert). Todo lo anterior se ha confirmado mediante espectroscopia FTIR (Fourier-Transform Infrared Spectroscopy)37. A lo anterior cabe añadir que el POL aumenta la sensibilidad del vaso al efecto térmico del láser al irradiar con alta frecuencia de pulso; lo que se cumple en el caso del láser empleado, ya que emite a 6 Hz36,37.
En el presente estudio el fototipo de las pacientes era de II a IV en ambos grupos y no se consideró una variable relevante dado que no hubo diferencias significativas entre al comparar los fototipos dentro del grupo A, o con los del grupo B. En el estudio controlado de Alòs et al se encontró como más frecuente la asociación HPE con los pacientes fototipo II, y que la HPE era más frecuente en el grupo en el que emplearon microespuma38. No obstante, en su estudio la concentración de microespuma era la mitad de la concentración líquida; en nuestro caso se han empleado concentraciones de microespuma un tercio inferiores respecto del líquido en el grupo A o incluso algo menores en el grupo B, ya que se sumaba la acción del láser.
En relación a la terapia compresiva (TC), desde los primeros tratamientos con microespuma se optó por recomendar medias de compresión graduada de 35 mm de Hg, siendo pioneros en esta indicación39. Se observó que el grado de cumplimiento era mayor si se empleaba en períodos cortos, ya que la finalidad era disminuir el fenómeno inflamatorio inicial asociado a la escleroterapia. De ahí que se indicara llevarlas durante 72 horas, día y noche salvo los momentos de higiene personal, tras el tratamiento y 3‑4 días más solo de día. Esta indicación es la que se sigue haciendo actualmente, aunque se utilice tratamiento combinado. Durante un año se realizó una encuesta entre nuestros pacientes destinada a esclarecer el grado de cumplimiento de llevar medias compresivas (datos pendientes de publicación); la mayoría de los pacientes refirió que nunca la llevaron más allá de la semana, aunque se hubieran indicado durante 3 semanas tal como indican la Guías Europeas de Consenso5.
Las presiones inferiores a 35 mm de Hg a nivel del tobillo disminuyen mucho más a nivel del muslo, hasta el punto de que la disminución del diámetro de la safena mayor es mínima cuando se valora mediante eco‑Doppler. Mayor efecto se obtiene sobre las tributarias, al ser más superficiales. Cuando se desdeñan los beneficios de la TC se hace desde estudios que han empleado presiones de 15 a 20 mm de Hg en esclerosis de troncos safenos40. Sin embargo, otros autores han obtenido diferencias significativas en la disminución de la HPE empleando presiones de 30 a 40 mm de Hg41. Los resultados observados en el presente estudio coinciden con los de Palm et al7 que, a su vez, se reafirman en los obtenidos una década antes por Weiss et al42.
El empleo de flebotónicos ha demostrado ser eficaz en el tratamiento de la enfermedad venosa crónica a lo largo del tiempo43; razón por la cual se consideró útil prescribir a los pacientes tratados el flebotónico descrito. Estudios posteriores han confirmado la utilidad de sulodexida como fármaco capaz de prevenir la HPE44.
Una vez instaurada la HPE, los tratamientos destinados a resolverla no aseguran resultados satisfactorios en todos los casos. Al ser la hemosiderina soluble en ácidos, se han propuesto tratamientos para ser formulados que contienen ácido tricloroacético (TCA) 20%, ácido retinoico 0,05% e hidroxiquinolona 2%23. Así mismo, teniendo en cuenta que la inflamación está implicada en la HPE, se ha estudiado la aplicación de corticoides tópicos de alta potencia; aunque, dado que los estudios se llevaron a cabo sobre un número reducido de casos, los resultados no fueron significativos45.
La utilización de quelantes del hierro, como la deferoxamina, también se ha propuesto; teniendo la vía tópica el hándicap de su difícil absorción dérmica, aunque se empleen agentes nanosomados. La alternativa es utilizarla por vía mesoterápica o subcutánea, requiriendo sesiones semanales en número variable de 4 a 8, en función de si los vasos tratados son superficiales y de diámetro reducido o son más profundos y diámetro de 3 mm o superior10,15. Su indicación, dados los inconvenientes y el tiempo de resolución, es en los casos en que la HPE persista más allá de los 6 meses.
Otra opción de tratamiento radica en el empleo de láseres, aunque los estudios son escasos y realizados con pocos pacientes. El primero en comunicar buenos resultados, empleando un láser de colorante pulsado de emisión en 510 nm, fue Goldman46. El láser lo aplicó sobre pacientes tratados con diferentes esclerosantes, sin especificar si los resultados alcanzados fueron mejores o se realizaron menos sesiones según el esclerosante. Posteriormente, Tafazzoli et al emplearon un láser Q‑switched de rubí de 694 nm para tratar HPE en 8 pacientes47. El aclaramiento completo de las pigmentaciones solo se consiguió en 2 pacientes, en uno no hubo mejoría y en el resto se resolvieron con tasas del 25 al 80%. Hay que añadir que el tratamiento con láseres es lento porque las sesiones deben espaciarse no menos de 8 semanas. Aunque se habla mucho sobre los láseres que emiten en picosegundos, hasta el momento no se han realizado comunicaciones al respecto.
El seguimiento de las recomendaciones por parte de las pacientes en ambos grupos explica la disminución de la HPE si se compara con las cifras de la literatura consultada. Es destacable la alta satisfacción con el tratamiento en ambos grupos, aunque significativamente mayor en el grupo B, incluyendo las pacientes que tuvieron HPE. Acometer un estudio retrospectivo no es tarea fácil, salvo que previamente se haya realizado una correcta recogida de datos. No obstante, creemos oportuno indicar la utilidad de realizar estudios prospectivos, aleatorizados y bien diseñados que puedan confirmar los resultados obtenidos en este retrospectivo sobre la menor incidencia de HPE con el tratamiento combinado.
Conclusiones
La HPE es el efecto adverso más frecuente tras la escleroterapia de varices de los miembros inferiores, en cualquiera de sus grados. Aunque es un efecto adverso menor, es especialmente molesto en aquellos casos cuya finalidad del tratamiento es estética. La resolución de esta complicación puede tomar un largo periodo de tiempo, por ello es esencial prevenirla ya que no existen tratamientos específicos una vez desarrollada.
Para su prevención es esencial el conocimiento y la correcta ejecución de la técnica, con un ajuste preciso de la cantidad y concentración del esclerosante acorde a las condiciones hemodinámicas del vaso a tratar.
La toma de flebotónicos por vía oral y tópica, junto a la terapia compresiva de 35 mm de Hg, puede ser de utilidad para disminuir la frecuencia de presentación de la HPE, al tiempo que pueden actuar conjuntamente para que la resolución sea más rápida.
El tratamiento de esclerosis debe ser controlado sistemáticamente para detectar y evacuar el esclerus, a ser posible en las primeras 2 semanas tras su formación, de acuerdo a las evidencias que recogen las guías de práctica clínica.
Los diversos tratamientos aplicados para resolver una HPE arrojan resultados dispares y precisan de estudios aleatorizados y controlados para su correcta valoración.
Declaración
Los autores declaran no tener conflicto de intereses con ningunos de los productos y/o aparatos mencionados.
Bibliografía
- Goldman MP. Complications and Adverse Sequelae of Sclerotherapy. In: The Vein Book. Academic Press Elsevier. 2007. p. 139‑155. https://doi.org/10.1016/B978-012369515-4/50018-1
- Goldman MP. Safety Profile of Sclerosing Agents. Dermatol Surg. 2019 Dec;45(12):1529‑1530. https://doi.org/10.1097/DSS.0000000000002169
- Rabe E, Pannier-Fischer F, Gerlach H, Breu FX, Guggenbichler S, Zabel M; German Society of Phlebology. Guidelines for sclerotherapy of varicose veins (ICD 10: I83.0, I83.1, I83.2, and I83.9). Dermatol Surg. 2004 May;30(5):687‑93; discussion 693. https://doi.org/10.1111/j.1524-4725.2004.30201.x
- Gillet J; for the Guideline Group. Complications and side effects: European Guidelines for Sclerotherapy in Chronic Venous Disorders. Phlebology. 2014 May;29(1 suppl):34‑38. https://doi.org/10.1177/0268355514526532
- Rabe E, Breu FX, Cavezzi A, Coleridge Smith P, Frullini A, Gillet JL, Guex JJ, Hamel-Desnos C, Kern P, Partsch B, Ramelet AA, Tessari L, Pannier F; Guideline Group. European guidelines for sclerotherapy in chronic venous disorders. Phlebology. 2014 Jul;29(6):338‑54. https://doi.org/10.1177/0268355513483280
- Guex JJ, Allaert FA, Gillet JL, Chleir F. Immediate and midterm complications of sclerotherapy: report of a prospective multicenter registry of 12,173 sclerotherapy sessions. Dermatol Surg. 2005 Feb;31(2):123‑8; discussion 128. https://doi.org/10.1111/j.1524-4725.2005.31030
- Palm MD, Guiha IC, Goldman MP. Foam sclerotherapy for reticular veins and nontruncal varicose veins of the legs: a retrospective review of outcomes and adverse effects. Dermatol Surg. 2010 Jun;36 Suppl 2:1026‑33. https://doi.org/10.1111/j.1524-4725.2010.01496.x
- Thibault PK, Wlodarczyk J. Correlation of serum ferritin levels and postsclerotherapy pigmentation. A prospective study. J Dermatol Surg Oncol. 1994 Oct;20(10):684‑6. https://doi.org/10.1111/j.1524-4725.1994.tb00453.x
- Scott C, Seiger E. Postsclerotherapy pigmentation. Is serum ferritin level an accurate indicator? Dermatol Surg. 1997 Apr;23(4):281‑2; discussion 283. https://doi.org/10.1111/j.1524-4725.1997.tb00044.x
- Gonzalez Ochoa AJ, Carrillo J, Manríquez D, Manrique F, Vazquez AN. Reducing hyperpigmentation after sclerotherapy: A randomized clinical trial. J Vasc Surg Venous Lymphat Disord. 2021 Jan;9(1):154‑162. https://doi.org/10.1016/j.jvsv.2020.06.019
- Bi M, Li D, Chen Z, Wang Y, Ren J, Zhang W. Foam sclerotherapy compared with liquid sclerotherapy for the treatment of lower extremity varicose veins: A protocol for systematic review and meta analysis. Medicine (Baltimore). 2020 May 29;99(22):e20332. https://doi.org/10.1097/MD.0000000000020332
- Nakano LC, Cacione DG, Baptista-Silva JC, Flumignan RL. Treatment for telangiectasias and reticular veins. Cochrane Database Syst Rev. 2021 Oct 12;10(10):CD012723. https://doi.org/10.1002/14651858.CD012723.pub2
- Kern P, Ramelet AA, Wutschert R, Bounameaux H, Hayoz D. Single-blind, randomized study comparing chromated glycerin, polidocanol solution, and polidocanol foam for treatment of telangiectatic leg veins. Dermatol Surg. 2004 Mar;30(3):367‑72; discussion 372. https://doi.org/10.1111/j.1524-4725.2004.30102.x
- Wollmann JC. The history of sclerosing foams. Dermatol Surg. 2004 May;30(5):694‑703; discussion 703. https://doi.org/10.1111/j.1524-4725.2004.30208.x
- Folch J, Alcolea JM. Actualización de fármacos empleados en mesoterapia. Med Estética. 2020;64(3):38‑44. https://doi.org/10.48158/MedicinaEstetica.064.06
- Leach BC, Goldman MP. Comparative trial between sodium tetradecyl sulfate and glycerin in the treatment of telangiectatic leg veins. Dermatol Surg. 2003 Jun;29(6):612‑4; discussion 615. https://doi.org/10.1046/j.1524-4725.2003.29148.x
- Green D. Persistent post-sclerotherapy pigmentation due to minocycline. Three cases and a review of post-sclerotherapy pigmentation. J Cosmet Dermatol. 2002 Dec;1(4):173‑82. https://doi.org/10.1111/j.1473-2165.2002.00048.x
- Goldman MP, Sadick NS, Weiss RA. Cutaneous necrosis, telangiectatic matting, and hyperpigmentation following sclerotherapy. Etiology, prevention, and treatment. Dermatol Surg. 1995 Jan;21(1):19‑29; quiz 31‑2. https://doi.org/10.1111/j.1524-4725.1995.tb00107.x
- Lopez L, Dilley RB, Henriquez JA. Cutaneous hyperpigmentation following venous sclerotherapy treated with deferoxamine mesylate. Dermatol Surg. 2001 Sep;27(9):795‑8. https://doi.org/10.1046/j.1524-4725.2001.01052.x
- Bunke-Paquette N. Complications of liquid sclerotherapy. In Bergan JJ, Bunke-Paquette N, Editors. The Vein Book, 2nd ed. New York. Oxford University Press; 2014. p. 115‑126.
- Tessari L, Cavezzi A, Frullini A. Preliminary experience with a new sclerosing foam in the treatment of varicose veins. Dermatol Surg. 2001 Jan;27(1):58‑60. https://doi.org/10.1111/j.1524-4725.2001.00192.x
- Cohen, J. Statistical Power Analysis for the Behavioral Sciences. Hillsdale, N.J. Lawrence Elrbraum. Second Edition. 1988. https://doi.org/10.4324/9780203771587
- Reina L. How to prevent complications and side effects from sclerotherapy of the lower limb veins. Phleboloinfology. 2018;25(2):137‑153. https://www.phlebolymphology.org/how-to-prevent-complications-and-side-effects-from-sclerotherapy-of-the-lower-limb-veins/
- Zimmet SE. Sclerotherapy treatment of telangiectasias and varicose veins. Tech Vasc Interv Radiol. 2003 Sep;6(3):116‑20. https://doi.org/10.1053/s1089-2516(03)00044-1
- Sadick NS. Choosing the appropriate sclerosing concentration for vessel diameter. Dermatol Surg. 2010 Jun;36 Suppl 2:976‑81. https://doi.org/10.1111/j.1524-4725.2009.01405.x
- Bush R, Bush P. Evaluation of sodium tetradecyl sulfate and polidocanol as sclerosants for leg telangiectasia based on histological evaluation with clinical correlation. Phlebology. 2017 Aug;32(7):496‑500. https://doi.org/10.1177/0268355516673768
- Reich-Schupke S, Weyer K, Altmeyer P, Stücker M. Treatment of varicose tributaries with sclerotherapy with polidocanol 0.5 % foam. Vasa. 2010 May;39(2):169‑74. https://doi.org/10.1024/0301-1526/a000023
- Breu FX, Guggenbichler S, Wollmann JC. 2nd European Consensus Meeting on Foam Sclerotherapy 2006, Tegernsee, Germany. Vasa. 2008 Feb;37 Suppl 71:1‑29.
- Parsi K, Exner T, Low J, Fung Ma DD, Joseph JE. In vitro effects of detergent sclerosants on clot formation and fibrinolysis. Eur J Vasc Endovasc Surg. 2011 Feb;41(2):267‑77. https://doi.org/10.1016/j.ejvs.2010.10.004
- Cooley-Andrade O, Jothidas A, Goh WX, Connor DE, Parsi K. Low-concentration detergent sclerosants stimulate white blood cells and release proinflammatory and proangiogenic cytokines in vitro. J Vasc Surg Venous Lymphat Disord. 2014 Oct;2(4):433‑40. https://doi.org/10.1016/j.jvsv.2014.02.005
- Goldman MP, Kaplan RP, Duffy DM. Postsclerotherapy hyperpigmentation: a histologic evaluation. J Dermatol Surg Oncol. 1987 May;13(5):547‑50. https://doi.org/10.1111/j.1524-4725.1987.tb00940.x
- Scultetus AH, Villavicencio JL, Kao TC, Gillespie DL, Ketron GD, Iafrati MD, Pikoulis E, Eifert S. Microthrombectomy reduces postsclerotherapy pigmentation: multicenter randomized trial. J Vasc Surg. 2003 Nov;38(5):896‑903. https://doi.org/10.1016/s0741-5214(03)00920-0
- Alcolea JM, Moreno-Moraga J, Grass M, Trelles M.A. Estudio comparativo del tratamiento de varices con microespuma y microespuma más láser. Medicina Estética. 2013;35(2):39‑47. https://doi.org/10.48158/MedicinaEstetica.035.01
- Moreno-Moraga J, Hernández E, Royo J, Alcolea J, Isarría MJ, Pascu ML, Smarandache A, Trelles M. Optimal and safe treatment of spider leg veins measuring less than 1.5 mm on skin type IV patients, using repeated low-fluence Nd:YAG laser pulses after polidocanol injection. Lasers Med Sci. 2013 May;28(3):925‑33. https://doi.org/10.1007/s10103-012-1180-6
- Moreno-Moraga J, Smarandache A, Pascu ML, Royo J, Trelles MA. 1064 nm Nd:YAG long pulse laser after polidocanol microfoam injection dramatically improves the result of leg vein treatment: a randomized controlled trial on 517 legs with a three-year follow‑up. Phlebology. 2014 Dec;29(10):658‑66. https://doi.org/10.1177/0268355513502786
- Moreno-Moraga J, Pascu ML, Alcolea JM, Smarandache A, Royo J, David F, Trelles MA. Effects of 1064‑nm Nd:YAG long-pulse laser on polidocanol microfoam injected for varicose vein treatment: a controlled observational study of 404 legs, after 5‑year-long treatment. Lasers Med Sci. 2019 Sep;34(7):1325‑1332. https://doi.org/10.1007/s10103-019-02736-1
- Dinache A, Pascu ML, Smarandache A. Spectral Properties of Foams and Emulsions. Molecules. 2021 Dec 20;26(24):7704. https://doi.org/10.3390/molecules26247704
- Alòs J, Carreño P, López JA, Estadella B, Serra-Prat M, Marinel-Lo J. Efficacy and safety of sclerotherapy using polidocanol foam: a controlled clinical trial. Eur J Vasc Endovasc Surg. 2006 Jan;31(1):101‑7. https://doi.org/10.1016/j.ejvs.2005.08.018
- Goldman MP. How to utilize compression after sclerotherapy. Dermatol Surg. 2002 Sep;28(9):860‑2. https://doi.org/10.1046/j.1524-4725.2002.02044.x
- Hamel-Desnos CM, Guias BJ, Desnos PR, Mesgard A. Foam sclerotherapy of the saphenous veins: randomised controlled trial with or without compression. Eur J Vasc Endovasc Surg. 2010 Apr;39(4):500‑7. https://doi.org/10.1016/j.ejvs.2009.11.027
- Nootheti PK, Cadag KM, Magpantay A, Goldman MP. Efficacy of graduated compression stockings for an additional 3 weeks after sclerotherapy treatment of reticular and telangiectatic leg veins. Dermatol Surg. 2009 Jan;35(1):53‑7; discussion 57‑8. https://doi.org/10.1111/j.1524-4725.2008.34382.x
- Weiss RA, Sadick NS, Goldman MP, Weiss MA. Post-sclerotherapy compression: controlled comparative study of duration of compression and its effects on clinical outcome. Dermatol Surg. 1999 Feb;25(2):105‑8. https://doi.org/10.1046/j.1524-4725.1999.08180.x
- Nicolaides A, Kakkos S, Baekgaard N, Comerota A, de Maeseneer M, Eklof B, Giannoukas AD, Lugli M, Maleti O, Myers K, Nelzén O, Partsch H, Perrin M. Management of chronic venous disorders of the lower limbs. Guidelines According to Scientific Evidence. Part I. Int Angiol. 2018 Jun;37(3):181‑254. https://doi.org/10.23736/S0392-9590.18.03999‑8
- Andreozzi GM, Bignamini AA, Davì G, Palareti G, Matuška J, Holý M, Pawlaczyk-Gabriel K, Džupina A, Sokurenko GY, Didenko YP, Andrei LD, Lessiani G, Visonà A; SURVET Study Investigators. Sulodexide for the Prevention of Recurrent Venous Thromboembolism: The Sulodexide in Secondary Prevention of Recurrent Deep Vein Thrombosis (SURVET) Study: A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial. Circulation. 2015 Nov 17;132(20):1891‑7. https://doi.org/10.1161/CIRCULATIONAHA.115.016930
- Friedmann DP, Liolios AM, Wu DC, Goldman MP, Eimpunth S. A Randomized, Double-Blind, Placebo-Controlled Study of the Effect of a High-Potency Topical Corticosteroid After Sclerotherapy for Reticular and Telangiectatic Veins of the Lower Extremities. Dermatol Surg. 2015 Oct;41(10):1158‑63. https://doi.org/10.1097/DSS.0000000000000467
- Goldman MP. Postsclerotherapy hyperpigmentation. Treatment with a flashlamp-excited pulsed dye laser. J Dermatol Surg Oncol. 1992 May;18(5):417‑22. https://doi.org/10.1111/j.1524-4725.1992.tb03695.x
- Tafazzoli A, Rostan EF, Goldman MP. Q‑switched ruby laser treatment for postsclerotherapy hyperpigmentation. Dermatol Surg. 2000 Jul;26(7):653‑6. https://doi.org/10.1046/j.1524-4725.2000.99268.x


