Eficacia y seguridad de los tratamientos faciales con ácido poliláctico.
Revisión sistemática
Introducción
El APLL es un polímero de la familia de los poli alfa-hidroxiácidos, sintetizado originalmente por químicos franceses en 1954 y utilizado de forma segura como material de sutura, en placas reabsorbibles y tornillos en cirugía ortopédica, neurológica y craneofacial. En Europa se aprobó en 1999, con el nombre de New‑Fill® y finalidad estética, para restaurar el volumen de las áreas deprimidas como pliegues, arrugas o cicatrices de la piel1. En 2004 fue aprobado por la FDA para la restauración de tejidos blandos en la lipoatrofia de pacientes con virus de la inmunodeficiencia humana (VIH). Posteriormente, en 2009, con el nombre de Sculptra® (Dermik Laboratories, Berwyn, PA, USA), su uso se extendió a la medicina estética, ampliándose sus indicaciones faciales a corporales, como manos, cuello, mamas o cicatrices atróficas2.
El producto se presenta como polvo liofilizado que contiene micropartículas de 40 a 63 µm de diámetro de APLL, en una base de carboximetilcelulosa y manitol apirógeno3. Las microesferas de APLL provocan una respuesta inflamatoria de cuerpo extraño subclínica, que conduce a su encapsulación, aproximadamente un mes después de la inyección4. A los 6 meses, coincidiendo con la desaparición de la respuesta inflamatoria, se evidencia un aumento de fibras de colágeno tipo I en la matriz extracelular que se mantiene durante 8 a 24 meses5. En estudios recientes también se ha demostrado la presencia de colágeno tipo III. Debido a la neocolagénesis que produce, el APLL es considerado no sólo un relleno facial sino un bioimplante. En el transcurso de 9 meses, las micropartículas de APLL se hidrolizan en monómeros que, a través de la degradación del ácido láctico, se eliminan por la respiración en forma de CO₂ y agua4.
Los efectos adversos más comunes de la inyección de APLL incluyen dolor, eritema, equimosis, edema, prurito, reacciones alérgicas, sangrado leve y pequeños hematomas, aunque la complicación más destacada es la formación de nódulos. Estos nódulos pueden ser de tipo granulomatoso o fibroso6; estos últimos se cree que pueden formarse por una inadecuada técnica de aplicación7. Por el contrario, los granulomas se deben generalmente a una reacción alérgica o inflamatoria del huésped que puede durar hasta 18 meses8. Histopatológicamente, los granulomas se presentan como fragmentos de partículas de APLL ovaladas, fusiformes o puntiagudas, birrefringentes al examen con luz polarizada, y rodeadas de células gigantes multinucleadas que se disponen en empalizada con la finalidad de aislarlo del tejido circundante8,9.
Se han descrito complicaciones más graves, aunque menos frecuentes, secundarias a una oclusión vascular inadvertida. Las áreas anatómicas de alto riesgo son la región glabelar, las sienes, el área central de la frente, la pirámide nasal y surco alar, los pliegues nasolabiales y labios. Las arterias más expuestas a la oclusión son: supratroclear, supraorbitaria, angular, nasal dorsal, nasal lateral, temporal superficial y labiales superiores e inferiores10.
También pueden producirse infecciones bacterianas, víricas (Herpes simplex) o fúngicas (Candida Spp.), aunque son poco habituales. En el caso de las infecciones bacterianas, si se presentan de forma temprana suelen ser debidas a Staphylococcus aureus o Streptococcus pyogenes11; por el contrario, si lo hacen más de 2 semanas después del tratamiento suelen deberse a microorganismos atípicos como micobacterias y Escherichia coli. En raras ocasiones pueden formar biofilms.
La reconstitución, hidratación, manipulación y colocación adecuadas del producto son fundamentales para evitar efectos adversos; además, deben seguirse unas correctas medidas de asepsia y antisepsia. La incidencia de nódulos fibrosos disminuye notablemente cuando se emplean volúmenes más altos (entre 8 y 9 ml) para la reconstitución del liofilizado, tiempos de hidratación más prolongados (hasta 48 horas), la inyección del producto se realiza a nivel supraperióstico (en cantidades por punto no superiores a 0,3 a 0,5 ml/cm²) o en la porción superior de la grasa subcutánea (aconsejable no superar de 0,1 a 0,3 ml/cm²) en lugar de en la dermis inferior7. El masaje postratamiento es fundamental para dispersar las partículas de APLL y evitar la formación de nódulos2. Otro detalle a tenerse en cuenta es no realizar las inyecciones en, o a través de, músculos activos; particularmente en los m. orbiculares del ojo o de los labios, donde los nódulos se producirían por atrapamiento del producto en las fibras musculares debido a su especial movimiento.
Los nódulos fibrosos palpables pueden eliminarse mediante la inyección de corticoesteroides o de ácido hialurónico intralesional y en la zona circundante. Recientemente, se ha observado que la inyección de un antimitótico, 5‑fluorouracilo, ofrece menos riesgo de atrofia cutánea en comparación con los corticosteroides. Asimismo, en los granulomas también está indicada la inyección de corticoesteroides o de 5‑fluorouracilo, pudiendo utilizar hidroxicloroquina o alopurinol por vía oral12. Es controvertido el empleo de la escisión quirúrgica; algunos autores advierten sobre el riesgo de formación de fístulas o abscesos, mientras que otros defienden el curetaje guiado por ultrasonografía13.
El riesgo del APLL de presentar reacciones inmunes tardías es mínimo, se podría afirmar que es biocompatible y absorbible y, debido al incremento de colágeno que induce (neocolagénesis) puede considerarse un relleno de larga duración2,9.
Material y método
Estrategia de búsqueda
Se realizó una revisión sistemática sobre la literatura existente sin límite temporal. Los artículos científicos se obtuvieron, empleando en la estrategia de búsqueda los descriptores polylactic fillers, en la base de datos Medline (PubMed) hasta marzo de 2021. De esta búsqueda inicial se obtuvieron 420 artículos. De ellos, se eliminaron 270 artículos en los que el APLL no se utilizaba con finalidad estética sino con otros usos médicos o no médicos. Además, se eliminaron otros 9 artículos que no hacían referencia al APLL o que ya no se encontraban disponibles. Tras este primer filtro, quedaron 141 artículos relacionados con medicina estética.
Criterios de inclusión y exclusión
Se incluyeron todos los ensayos clínicos aleatorizados y no aleatorizados, estudios observacionales tanto prospectivos de base individual como retrospectivos y series de casos en los que se inyectó APLL a pacientes en la zona facial y estuvieran publicados en inglés, francés o español. Se excluyeron las revisiones sistemáticas, metaanálisis, y estudios de cualquier otra zona corporal que no fuera el rostro, o se hubieran realizado en modelos animales.
Al final, se seleccionaron 43 artículos que cumplían con los criterios de selección establecidos. Para la revisión se leyó el texto completo de todos los artículos seleccionados (Figura 1).

Resultados
De los 43 artículos seleccionados no se encontraron estudios anteriores a 2004; 8 de ellos (18%) datan de 2009. Cabe destacar que 18 artículos (42%) solo estudiaron casos o series de casos de 5 o menos pacientes.
La seguridad del APLL fue evaluada en 42 de los 43 artículos, 98% de los estudiados. Sin embargo, la eficacia solo se tuvo en cuenta en 24 de ellos (56%). En ambos casos, se consideró el número de pacientes (n) tratados en cada estudio y el tiempo (t) en meses de seguimiento máximo tras la aplicación del relleno. Para el análisis estadístico se han utilizado como indicadores descriptivos la media aritmética (m = promedio) como medida de tendencia central y el recorrido (r = rango) como grado de dispersión.
1. Resultados de seguridad

Para estudiar la seguridad clínica se cuantificó el número de pacientes que presentaron complicaciones (nC), asignándose un valor numérico según la gravedad de las mismas:
- 0: Sin complicaciones o efectos adversos leves esperados.
- 1: Complicaciones leves: nódulos fibrosos o reacción alérgica local.
- 2: Complicaciones moderadas: granulomas o infección local.
- 3: Complicaciones graves: necrosis tisular, ceguera u oftalmoplejía.
La población total de los estudios fue de 1.801 pacientes, de los que 1.663 (92%) no presentaron complicaciones o tuvieron efectos adversos leves esperables, como eritema, dolor, equimosis, edema, prurito, reacciones alérgicas leves y locales, sangrado puntual o pequeños hematomas, cuya resolución demoró pocos días (Tabla I).
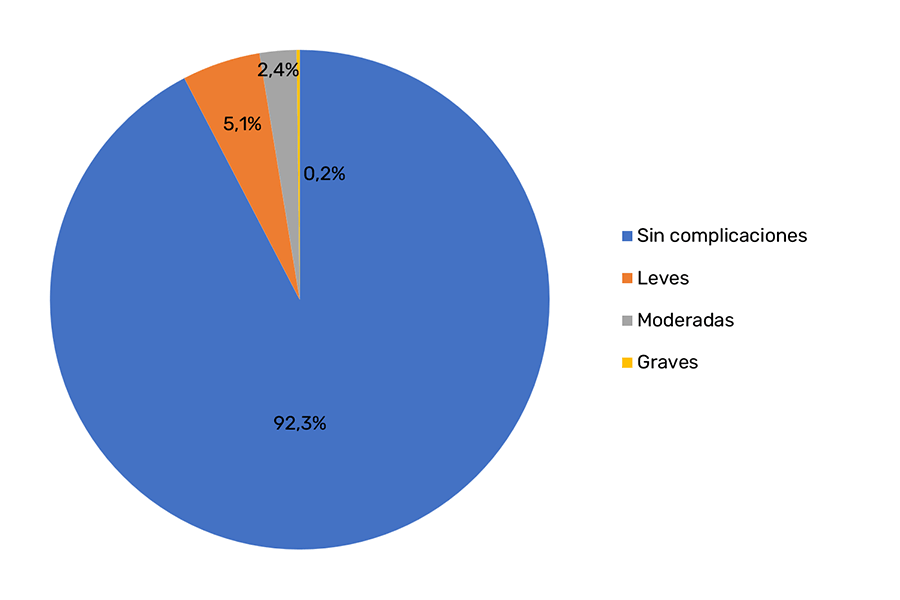
Las complicaciones sucedieron en 138 pacientes, lo que supone un 7,7% del total de casos estudiados; en 92 pacientes (5,1%) fueron leves, en 43 (2,4%) moderadas y en 3 de ellos graves (0,2%) (Figura 2). A su vez, entre las complicaciones leves, sólo hubo un caso de reacción alérgica; el resto, 91 pacientes, presentó nódulos fibrosos. De los 43 pacientes con complicaciones moderadas, un caso se atribuyó a infección local por Mycobacterium mucogenicum; mientras los otros 42 pacientes tuvieron granulomas14. De las 3 complicaciones graves, 2 fueron casos de ceguera; uno debido a isquemia aguda del nervio óptico, por oclusión de la arteria central de la retina, con extensión al lóbulo frontal y otro caso por isquemia orbitaria15,16. El tercer caso se debió a oclusión de la arteria mentoniana17. Los pacientes estudiados tuvieron un período de seguimiento en torno a los 24 meses.
Considerando solo las complicaciones que tuvieron los 138 pacientes cabe especificar que fueron leves en el 66,7% de los casos, correspondiendo a nódulos fibrosos el 65,9%; en el 31,1% se consideraron moderadas, siendo la mayoría granulomas (30,5%); de las graves el 2,2% correspondió a las isquemias, mientras que los casos de reacción alérgica e infección representaron un 0,7% cada una de ellas (Figura 3).

2. Resultados de eficacia
La eficacia se analizó en 24 artículos como sigue:
- 8 artículos (33,3%) valoraban el rejuvenecimiento cutáneo en pacientes con flacidez o arrugas.
- 12 artículos (50%) evaluaban pacientes con lipodistrofia: 9 se asociaron al virus de la inmunodeficiencia humana (VIH) y 4 a enfermedades autoinmunes, tipo lupus localizado o discoide y lipodistrofia parcial adquirida.
- 4 artículos (16,7%) estudiaban pacientes con cicatrices cutáneas de acné.
Dado que los artículos agrupaban en su estudio aplicaciones diferentes, se evaluó la eficacia de cada una por separado. La evaluación de la eficacia clínica (EC) de los tratamientos se realizó por medio de una escala semicuantitativa a la que se asignaron los valores de la siguiente manera: –1, empeoramiento; 0, sin eficacia o escasa; 1, moderada; 2, buena; 3, muy buena. Para puntuar cada trabajo se tuvieron en cuenta los resultados de las pruebas diagnósticas.
Se define como eficacia clínica ponderada (ECP) el producto de multiplicar la EC por en número de casos (n), siendo la eficacia global o grupal (EG) el cociente entre la ECP y la eficacia clínica máxima (ECM). También se consideró el valor promedio de cada caso en los artículos que estudiaban series de casos. En relación a lo anterior, se han obtenido los resultados de eficacia de los tratamientos de APLL en 3 situaciones clínicas:
2.1. Rejuvenecimiento cutáneo
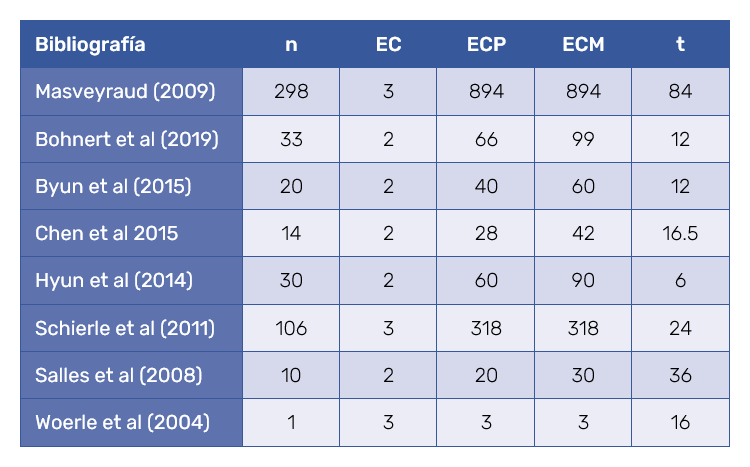
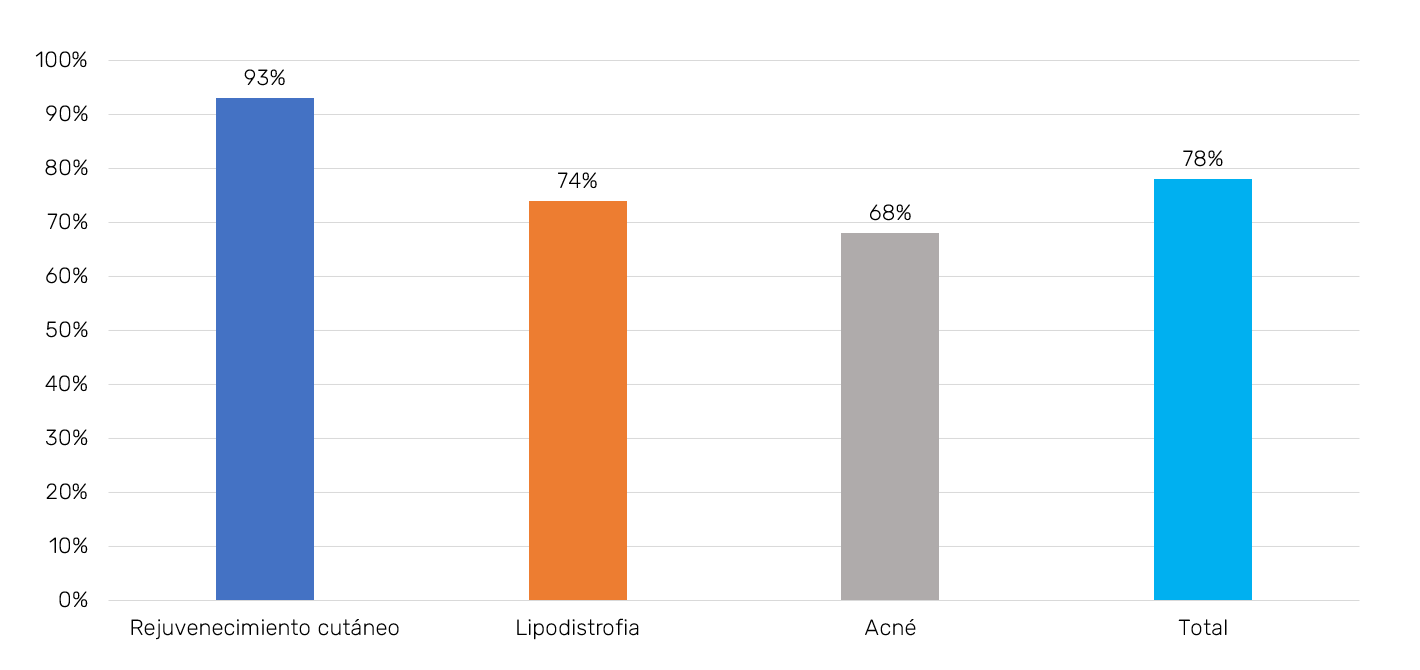
La EG en rejuvenecimiento cutáneo calculada sobre los tratamientos en 512 pacientes fue del 93%, con un seguimiento promedio de 26 meses (Tabla II).
2.2. Lipodistrofia
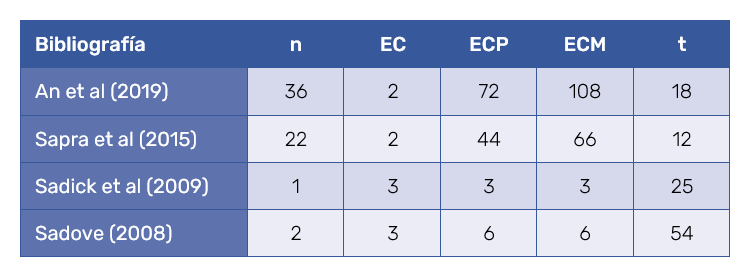
La EG en lipodistrofia sobre los resultados en 375 pacientes supuso un 74%, con 17 meses de seguimiento promedio (Tabla III).

2.3. Cicatrices de acné
La EG en el tratamiento de cicatrices secundarias de acné, calculada sobre 61 pacientes fue del 68%, alcanzando el seguimiento promedio 27 meses (Tabla IV).
Los resultados anteriores resultan de estudiar la EG de cada subgrupo por separado. De forma conjunta, la media aritmética de las EG de los tratamientos con APLL es del 78%; calculada sobre 948 pacientes con un seguimiento promedio de 23 meses (Figura 4).
Discusión
El examen de eficacia muestra que una de las indicaciones principales del tratamiento con APLL, en el que se alcanzan mejores resultados, es el rejuvenecimiento cutáneo; ya que ofrece una objetivable mejoría de la calidad de la piel. Esta alta eficacia indica que las inyecciones de APLL logran un efecto de aumento del volumen y grosor de la piel en cuanto son capaces de generar nuevo colágeno1,2,4,5. Además, el APLL tiene un efecto rejuvenecedor de la calidad de la piel, aumentando la hidratación y, por ende, la elasticidad de la misma, al tiempo que reduce la dilatación de los poros, aportando suavidad y disminuyendo las hiperpigmentaciones9. De otra parte, se ha planteado la hipótesis de que las inyecciones de APLL dirigidas a la dermis profunda estimulan las células madre adiposas en la hipodermis superior, lo que induciría que éstas secretaran factores de crecimiento, contribuyendo a la regeneración de los tejidos a través de la bioestimulación de los fibroblastos con el consiguiente rejuvenecimiento de la zona de relleno10.
El empleo del APLL y la eficacia del tratamiento en la lipodistrofia ha sido ampliamente estudiada, principalmente en pacientes con tratamiento por antirretrovirales por infección del VIH18‑20. En estos casos, al buen resultado alcanzado por el efecto del volumen y la mejoría de la textura cutánea se unen los beneficios psicológicos de la inyección de APLL al eliminar el estigma social de pacientes VIH positivos21. No obstante, aunque el uso de APLL conlleva un elevado grado de eficacia en el tratamiento de la lipodistrofia, algunos autores defienden que otras técnicas como la lipotransferencia podrían ser más eficaces; aunque esta técnica no está exenta de efectos adversos y hay que contar que los pacientes tengan una zona dadora adecuada, considerando que la lipoatrofia no es exclusiva de la cara22.
Otra patología, en que el empleo de inyecciones de APLL se ha mostrado eficaz, es en el tratamiento de las cicatrices secundarias a las formas de acné severo. Aunque el grado de eficacia alcanzado no es tan elevado como en las otras condiciones analizadas, rejuvenecimiento y lipodistrofia, conviene recordar que el número de pacientes que forma parte de los estudios clínicos analizados es sensiblemente menor23‑25. Además, las cicatrices provocadas por el acné, especialmente las denominadas “en pico de hielo” precisan de tratamientos combinados para su atenuación, como los que ofrecen los láseres fraccionales de Er:YAG y/o de CO₂.
Los tratamientos con APLL no están exentos de riesgo como se desprende del análisis efectuado26‑28. En general, toda práctica con materiales de relleno inyectables puede presentar efectos adversos locales, inherentes a la propia técnica, como dolor, eritema, equimosis, edema, prurito o hematomas29. Estos efectos no deseados son esperables, y su completa resolución en un corto plazo de tiempo hace que no se tengan en cuenta para los estudios de seguridad30‑33.
Si la reacción inflamatoria es persistente se le da el nombre de complicación. Si bien es cierto que las complicaciones mayores ocurren en un porcentaje muy escaso de pacientes, el médico debe conocerlas para tratarlas de forma inmediata. Se ha comprobado que la complicación más frecuente tras la aplicación de APLL es la formación de nódulos fibrosos34,35. Una práctica depurada, unida a una buena técnica de inyección y al exhaustivo conocimiento de los planos anatómicos, junto a la correcta reconstitución e hidratación del PLLA, reducirá la incidencia de aparición de estos nódulos36,37.
Otro aspecto importante es la obligada aplicación de las pertinentes normas de asepsia y antisepsia antes, durante y después de cualquier tratamiento con inyectables. En ese sentido, es destacable que, de los artículos analizados, sólo uno describe una complicación por sobreinfección bacteriana14. Sin embargo, la formación de granulomas es una complicación reseñable, representando la fracción más importante de las mismas38‑40. Las reacciones alérgicas, por el contrario, ocurren en un número muy escaso de pacientes, cifrado en el 0,7% de los casos11,12.
Las complicaciones graves son, por fortuna, muy poco frecuentes (0,7%); destacando el hecho de que 2 de los 3 pacientes en los que ocurrieron eran VIH positivos8,12. Esto podría ser debido a que se han realizado más estudios en pacientes VIH positivos al tener una clara indicación del tratamiento de la lipodistrofia con APLL. No obstante, podría considerarse que se trata de un virus que se ha descrito como potencialmente protrombótico, un hecho que favorecería la aparición de eventos isquémicos15‑17.
Los resultados obtenidos de la utilización del APLL en este análisis muestran unos resultados altamente favorables para su utilización41,42. Aunque no conviene olvidar las limitaciones del presente estudio; la primera es la subjetividad, principalmente en la evaluación de la EG, puesto que la asignación de los valores numéricos siguió una escala semicuantitativa adaptada para tal fin, como una manera de uniformar los valores en función de los resultados de las pruebas complementarias y las escalas de satisfacción que otorgaron los respectivos autores. La segunda a considerar es la falta de artículos con valoraciones de EC suficientemente precisas, sobre todo los referentes al acné, lo que podría constituir un sesgo para los resultados. Es preciso señalar que sólo se estudió la eficacia y seguridad del tratamiento con APLL en aplicaciones faciales, aunque su aplicación se ha extendido a otras áreas corporales muy diversas, de cuyo estudio podrían obtenerse resultados distintos.
Por último, mencionar que faltan estudios de eficacia clínica que no solo estén basados en exploraciones complementarias, sino que deberían apoyarse en registros fotográficos de calidad evaluados por observadores independientes43.
Conclusiones
Las indicaciones de tratamiento con APLL no han dejado de crecer. Su aplicación aporta numerosas ventajas, destacando la duración prolongada de sus efectos debido al estímulo inducido sobre la neocolagénesis.
Es preciso resaltar la alta eficacia de los tratamientos con APLL y el elevado perfil de seguridad que presenta.
El APLL es un producto que debe ser utilizado por médicos expertos, ya que requiere una técnica de aplicación más depurada que otros productos de relleno.
Declaración
Los autores manifiestan no tener conflicto de intereses.
Bibliografía
- Palm MD, Woodhall KE, Butterwick KJ, Goldman MP. Cosmetic use of poly‑l-lactic acid: a retrospective study of 130 patients. Dermatol Surg. 2010 Feb;36(2):161‑70. https://doi.org/10.1111/j.1524-4725.2009.01419.x
- Vleggaar D. Facial volumetric correction with injectable poly‑L-lactic acid. Dermatol Surg. 2005 Nov;31(11 Pt 2):1511‑7; discussion 1517‑8. https://doi.org/10.2310/6350.2005.31236
- Haneke E. Adverse effects of fillers and their histopathology. Facial Plast Surg. 2014 Dec;30(6):599‑614. https://doi.org/10.1055/s-0034-1396755
- Woerle B, Hanke CW, Sattler G. Poly‑L-lactic acid: a temporary filler for soft tissue augmentation. J Drugs Dermatol. 2004 Jul‑Aug;3(4):385‑9.
- Fitzgerald R, Vleggaar D. Facial volume restoration of the aging face with poly‑l-lactic acid. Dermatol Ther. 2011 Jan‑Feb;24(1):2‑27. https://doi.org/10.1111/j.1529-8019.2010.01375.x
- Beleznay K, Carruthers JD, Humphrey S, Jones D. Avoiding and Treating Blindness From Fillers: A Review of the World Literature. Dermatol Surg. 2015 Oct;41(10):1097‑117. https://doi.org/10.1097/dss.0000000000000486
- De Boulle K. Management of complications after implantation of fillers. J Cosmet Dermatol. 2004 Jan;3(1):2‑15. https://doi.org/10.1111/j.1473-2130.2004.00058.x
- Alijotas-Reig J, Garcia-Gimenez V y Vilardell-Tarres M. Late-Onset Immune-Mediated Adverse Effects after Poly‑L-Lactic Acid Injection in Non‑HIV Patients: Clinical Findings and Long-Term Follow‑Up. Dermatology. 2009; 219(4):303‑8. https://doi.org/10.1159/000243804
- Olivier Masveyraud F. Rajeunissement facial par l'acide L‑polylactique : à propos de 298 cas consécutifs [Facial rejuvenation using L‑polylactic acid: about 298 successive cases]. Ann Chir Plast Esthet. 2011 Apr;56(2):120‑7. French. https://doi.org/10.1016/j.anplas.2010.09.011
- Byun SY, Seo KI, Shin JW, et al. Objective Analysis of Poly‑L-Lactic Acid Injection Efficacy in Different Settings. Dermatol Surg. 2015 Dec;41 Suppl 1:S314‑20. https://doi.org/10.1097/dss.0000000000000552
- Monheit GD, Rohrich RJ. The nature of long-term fillers and the risk of complications. Dermatol Surg. 2009 Oct;35 Suppl 2:1598‑604. https://doi.org/10.1111/j.1524-4725.2009.01336.x
- Daines SM, Williams EF. Complications associated with injectable soft-tissue fillers: a 5‑year retrospective review. JAMA Facial Plast Surg. 2013 May;15(3):226‑31. https://doi.org/10.1001/jamafacial.2013.798
- Wolfram D, Tzankov A, Piza-Katzer H. Surgery for foreign body reactions due to injectable fillers. Dermatology. 2006;213(4):300‑4. https://doi.org/10.1159/000096193
- Fiore R 2nd, Miller R, Coffman SM. Mycobacterium mucogenicum infection following a cosmetic procedure with poly‑L-lactic acid. J Drugs Dermatol. 2013 Mar;12(3):353‑7.
- Ragam A, Agemy SA, Dave SB, Khorsandi AS, Banik R. Ipsilateral Ophthalmic and Cerebral Infarctions After Cosmetic Polylactic Acid Injection Into the Forehead. J Neuroophthalmol. 2017 Mar;37(1):77‑80. https://doi.org/10.1097/wno.0000000000000459
- Roberts SA, Arthurs BP. Severe visual loss and orbital infarction following periorbital aesthetic poly‑(L)-lactic acid (PLLA) injection. Ophthalmic Plast Reconstr Surg. 2012 May‑Jun;28(3):e68‑70. https://doi.org/10.1097/iop.0b013e3182288e4d
- Yuan JT, Chang TW, Yu SS, Arron ST. Mental Artery Occlusion From Poly‑L-Lactic Acid Injection at the Lateral Chin. Dermatol Surg. 2017 Nov;43(11):1402‑1405. https://doi.org/10.1097/dss.0000000000001103
- Bohnert K, Dorizas A, Lorenc P, Sadick NS. Randomized, Controlled, Multicentered, Double-Blind Investigation of Injectable Poly‑L-Lactic Acid for Improving Skin Quality. Dermatol Surg. 2019 May;45(5):718‑724. https://doi.org/10.1097/dss.0000000000001772
- Zhang AJ, Moraites E, Goldfarb N, Liszewski W, Farah RS. Acquired partial lipodystrophy treated with poly‑L-lactic acid and hyaluronic acid fillers: a case report. J Cosmet Laser Ther. 2019;21(4):201‑202. https://doi.org/10.1080/14764172.2018.1511909
- Kates LC, Fitzgerald R. Poly‑L-lactic acid injection for HIV-associated facial lipoatrophy: treatment principles, case studies, and literature review. Aesthet Surg J. 2008 Jul‑Aug;28(4):397‑403. https://doi.org/10.1016/j.asj.2008.06.005
- Nelson L, Stewart KJ. Experience in the treatment of HIV-associated lipodystrophy. J Plast Reconstr Aesthet Surg. 2008;61(4):366‑71. https://doi.org/10.1016/j.bjps.2007.10.031
- Cox SE. Clinical experience with filler complications. Dermatol Surg. 2009 Oct;35 Suppl 2:1661‑6. https://doi.org/10.1111/j.1524-4725.2009.01345.x
- Sapra S, Stewart JA, Mraud K, Schupp R. A Canadian study of the use of poly‑L-lactic acid dermal implant for the treatment of hill and valley acne scarring. Dermatol Surg. 2015 May;41(5):587‑94. https://doi.org/10.1097/dss.0000000000000366
- Sadick NS, Palmisano L. Case study involving use of injectable poly‑L-lactic acid (PLLA) for acne scars. J Dermatolog Treat. 2009;20(5):302‑7. https://doi.org/10.1080/09546630902817879
- Sadove R. Injectable poly‑L: -lactic acid: a novel sculpting agent for the treatment of dermal fat atrophy after severe acne. Aesthetic Plast Surg. 2009 Jan;33(1):113‑6. https://doi.org/10.1007/s00266-008-9242-7
- Lin CH, Chiang CP, Wu BY, Gao HW. Filler migration to the forehead due to multiple filler injections in a patient addicted to cosmetic fillers. J Cosmet Laser Ther. 2017 Apr;19(2):124‑126. https://doi.org/10.1080/14764172.2016.1248441
- Bachmann F, Erdmann R, Hartmann V, Wiest L, Rzany B. The spectrum of adverse reactions after treatment with injectable fillers in the glabellar region: results from the Injectable Filler Safety Study. Dermatol Surg. 2009 Oct;35 Suppl 2:1629‑34. https://doi.org/10.1111/j.1524-4725.2009.01341.x
- Hyun MY, Lee Y, No YA, et al. Efficacy and safety of injection with poly‑L-lactic acid compared with hyaluronic acid for correction of nasolabial fold: a randomized, evaluator-blinded, comparative study. Clin Exp Dermatol. 2015 Mar;40(2):129‑35. https://doi.org/10.1111/ced.12499
- No YA, Seok J, Hyun MY, Kwon TR, Oh CT, Choi EJ, Kim BJ. Long-Term (24‑Month) Safety Evaluation of Poly‑DL-Lactic Acid Filler Injection for the Nasolabial Fold: A Multicenter, Open, Randomized, Evaluator-Blind, Active-Controlled Design. Plast Reconstr Surg. 2015 Jun;135(6):1074e‑1075e. https://doi.org/10.1097/prs.0000000000001247
- Schierle CF, Casas LA. Nonsurgical rejuvenation of the aging face with injectable poly‑L-lactic acid for restoration of soft tissue volume. Aesthet Surg J. 2011 Jan;31(1):95‑109. https://doi.org/10.1177/1090820x10391213
- van Rozelaar L, Kadouch JA, Duyndam DA, Nieuwkerk PT, Lutgendorff F, Karim RB. Semipermanent filler treatment of HIV-positive patients with facial lipoatrophy: long-term follow‑up evaluating MR imaging and quality of life. Aesthet Surg J. 2014 Jan 1;34(1):118‑32. https://doi.org/10.1177/1090820x13515270
- Salles AG, Lotierzo PH, Gimenez R, Camargo CP, Ferreira MC. Evaluation of the poly‑L-lactic acid implant for treatment of the nasolabial fold: 3‑year follow‑up evaluation. Aesthetic Plast Surg. 2008 Sep;32(5):753‑6. https://doi.org/10.1007/s00266-008-9182-2
- O'Daniel G. Management of Late-Onset, Recurrent Facial Nodular Reaction After Poly‑L-Lactic (PLLA) Injections. J Drugs Dermatol. 2017 Dec 1;16(12):1297‑1299.
- Stewart DB, Morganroth GS, Mooney MA, Cohen J, Levin PS, Gladstone HB. Management of visible granulomas following periorbital injection of poly‑L-lactic Acid. Ophthalmic Plast Reconstr Surg. 2007 Jul‑Aug;23(4):298‑301. https://doi.org/10.1097/iop.0b013e318070d773
- Avery C, Clifford N. Foreign body granulomatous reaction of the temporal region following dermal filler administration. Br J Oral Maxillofac Surg. 2010 Sep;48(6):488. https://doi.org/10.1016/j.bjoms.2010.06.008
- Rossner F, Rossner M, Hartmann V, Erdmann R, Wiest LG, Rzany B. Decrease of reported adverse events to injectable polylactic acid after recommending an increased dilution: 8‑year results from the Injectable Filler Safety study. J Cosmet Dermatol. 2009 Mar;8(1):14‑8. https://doi.org/10.1111/j.1473-2165.2009.00417.x
- Borelli C, Kunte C, Weisenseel P, Thoma-Greber E, Korting HC, Konz B. Deep subcutaneous application of poly‑L-lactic acid as a filler for facial lipoatrophy in HIV-infected patients. Skin Pharmacol Physiol. 2005 Nov‑Dec;18(6):273‑8. https://doi.org/10.1159/000087608
- Guaraldi G, Orlando G, De Fazio D, et al. Comparison of three different interventions for the correction of HIV-associated facial lipoatrophy: a prospective study. Antivir Ther. 2005;10(6):753‑9.
- Lafaurie M, Dolivo M, Girard PM, May T, Bouchaud O, Carbonnel E, Madelaine I, Loze B, Porcher R, Molina JM; ANRS 132 SMILE study group. Polylactic acid vs. polyacrylamide hydrogel for treatment of facial lipoatrophy: a randomized controlled trial [Agence Nationale de Recherches sur le SIDA et les Hépatites Virales (ANRS) 132 SMILE]. HIV Med. 2013 Aug;14(7):410‑20. https://doi.org/10.1111/hiv.12021
- Bachmann F, Erdmann R, Hartmann V, Becker-Wegerich P, Wiest L, Rzany B. Adverse reactions caused by consecutive injections of different fillers in the same facial region: risk assessment based on the results from the Injectable Filler Safety study. J Eur Acad Dermatol Venereol. 2011 Aug;25(8):902‑12. https://doi.org/10.1111/j.1468-3083.2010.03878.x
- Burgess CM, Quiroga RM. Assessment of the safety and efficacy of poly‑L-lactic acid for the treatment of HIV-associated facial lipoatrophy. J Am Acad Dermatol. 2005 Feb;52(2):233‑9. https://doi.org/10.1016/j.jaad.2004.08.056
- Tagle JM, Macchetto PC, Durán Páramo RM. Clinical performance of a dermal filler containing natural glycolic Acid and a polylactic Acid polymer: results of a clinical trial in human immunodeficiency virus subjects with facial lipoatrophy. J Clin Aesthet Dermatol. 2010 Feb;3(2):42‑7.
- Chen HH, Javadi P, Daines SM, Williams EF 3rd. Quantitative assessment of the longevity of poly‑L-lactic acid as a volumizing filler using 3‑dimensional photography. JAMA Facial Plast Surg. 2015 Jan‑Feb;17(1):39‑43. https://doi.org/10.1001/jamafacial.2014.867



