Tratamiento del melasma mediante mesoterapia con ácido tranexámico, peelings y cosméticos tópicos
peels and topical cosmetics
Introducción
El melasma es una hipermelanosis adquirida de la piel y potenciada por la exposición solar. Aparece en mejillas, frente, labio superior, nariz, mentón y, a veces, en el cuello. Afecta a ambos sexos, con predominio en mujeres (80% de los casos). La afección aparece en edades comprendidas de 11 a 49 años (media 30 años) y causa una importante alteración cosmética, estrés y vergüenza, afectando la calidad de vida de los pacientes que la padecen1. El tratamiento del melasma sigue siendo insatisfactorio, especialmente en individuos con fototipos altos, porque no existe un método universalmente efectivo. Los agentes hipopigmentantes (hidroquinona, ácido retinoico, ácido kójico, ácido azelaico), los peelings químicos (ácido glicólico, ácido tricloroacético, ácido salicílico, ácido láctico) y los métodos físicos (láser, dermoabrasión) tienen una eficacia variable y limitada inherente a la presentación de efectos adversos1. El uso de varias terapias tópicas con diferentes mecanismos de acción es preferible a la monoterapia2. Los peelings químicos se proponen como terapia de segunda línea para el tratamiento del melasma3. En años recientes se ha investigado la terapia con láser para tratar el melasma, siendo preferibles los láseres no ablativos sobre los ablativos, debido a causar menos inflamación, y menor inducción de hiperpigmentación postinflamatoria (HPI). Los láseres en modo Q‑switched (Alejandrita y Nd:YAG) en monoterapia se ha observado que no tienen beneficios a largo plazo en el tratamiento. Sin embargo, en un estudio reciente se ha encontrado una mejora significativa en la pigmentación con láser Q‑switched de Nd:YAG, con baja fluencia3.
Otro tipo de tratamiento que se utiliza para el melasma es la administración de ácido tranexámico (ATX) ya sea por vía tópica, oral o intradérmica4. La terapia oral con ATX se muestra efectiva en dosis de 500 a 1.500 mg al día, inferiores a la dosis habitual para reducir el sangrado excesivo. La duración de la terapia en diferentes estudios es variable, de 1 mes a 6 meses; por lo general, un mes después del tratamiento, se puede ver la mejora de la hiperpigmentación4.
El ATX por vía oral se tolera bien y los efectos secundarios comunes incluyen malestar gastrointestinal e irregularidades menstruales5. Los efectos secundarios graves, como la trombosis venosa profunda, la embolia pulmonar masiva y el infarto agudo de miocardio son raros con las bajas dosis utilizadas en el tratamiento del melasma6; sin embargo, deben tenerse presentes en pacientes en quienes estaría contraindicada la terapia vía oral.
La aplicación de ATX mediante microinyecciones dérmicas parece ser eficaz para el tratamiento del melasma. No se han informado efectos secundarios graves, aparte de la sensación de ardor y el eritema, que fueron principalmente transitorios4. En un estudio realizado por Lee JH et al, se concluyó que la mesoterapia con ATX puede utilizarse como un tratamiento efectivo y seguro en pacientes con melasma7.
El objetivo del siguiente estudio es determinar la eficacia del AT al 5%, aplicado mediante mesoterapia, como alternativa y/o complemento a los tratamientos convencionales establecidos, además de valorar el riesgo de posibles efectos secundarios.
Epidemiología
La prevalencia del melasma varía según la etnia, el fototipo de la piel y la intensidad de la exposición al sol. En 2010, en Brasil, un país con alta prevalencia, se realizó una encuesta a 1500 adultos en consultas de dermatología, y se encontró que un 23,6% de los hombres y un 29,9% de las mujeres presentaban melasma8. Un estudio multicéntrico, con 953 pacientes de tres regiones diferentes de Brasil, identificó que 13% tenían fototipo II, 36% fototipo III, 40% fototipo IV y 10% fototipo V8. La incidencia de melasma en España es desconocida, aunque es motivo frecuente de consulta en clínica.
Características
La patogenia no se conoce con certeza, pero se consideran importantes las influencias genéticas y hormonales en combinación con las radiaciones UV9. Estudios histopatológicos mostraron que los melanocitos epidérmicos en el melasma son más activos que en la piel normal; están agrandados, con dendritas prominentes y una mayor síntesis de eumelanina. También muestran mayor actividad mitocondrial, del aparato de Golgi, retículo endoplasmático rugoso y ribosomas que, al microscopio electrónico se expresa como mayor actividad melanocítica10. Aunque hasta ahora no se ha identificado ningún gen específico en la patogénesis del melasma, puede tratarse de una interacción multigénica que implica variaciones en las respuestas de melanocitos o queratinocitos a diferentes factores de estimulación, que pueden explicar el amplio espectro clínico de patrones de melasma y la distinta capacidad de respuesta al tratamiento10. Los factores desencadenantes son variados e incluyen anticonceptivos orales, tratamiento con estrógenos, disfunción ovárica o tiroidea leve, tumores ováricos, factores cosméticos, factores nutricionales, fármacos citotóxicos, agentes fotoalérgicos y antiepilépticos, entre otros9.
Las lesiones propias del melasma consisten en máculas de color amarronado, de bordes irregulares y distribución simétrica en zonas expuestas al sol, preferentemente en la cara, y con frecuencia muestran un patrón de coalescencia reticulado. La exposición al sol intensifica las lesiones9. Los tres patrones principales de distribución de las lesiones son: centrofacial (63%, frente, nariz, mentón y labio superior), malar (21%, nariz y mejillas), y mandibular (16%, ramas del maxilar inferior). El melasma también puede comprometer la región anterior del tórax y el área dorsal de los antebrazos. La luz de Wood ayuda a identificar mejor la distribución y profundidad del melasma.
Diagnóstico diferencial
El diagnóstico diferencial para el melasma incluye liquen plano pigmentoso, lupus eritematoso discoide, dermatitis fototóxica, fitofotodermatitis, dermatitis de contacto pigmentada, pigmentación inducida por fármacos, poiquilodermia de Civatte, erythromelanosis follicularis faciei, ocronosis, nevo de Hori, argiria, nevo de Ota, lentigos, efélides, amiloidosis macular e hiperpigmentación post-inflamatoria11. Una cuidadosa historia clínica, unida al examen de la piel por lámpara de Wood y dermatoscopio, el reconocimiento de trastornos inflamatorios concomitantes y una biopsia de piel son de mucha ayuda para hacer un diagnóstico correcto12.
Evaluación del melasma
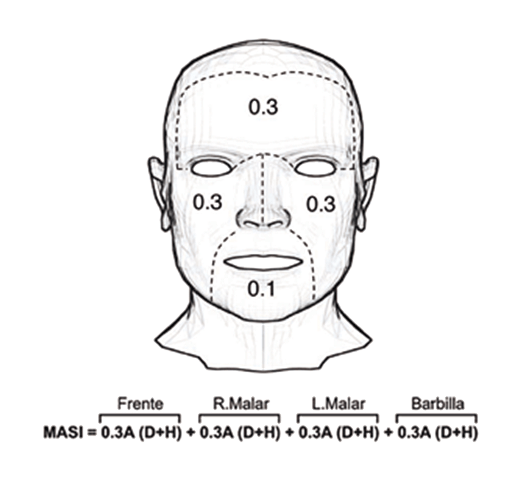
El índice de área y severidad de melasma (MASI) es una herramienta muy útil para medir la severidad clínica del melasma13,14; fue creado por Kimbrough-Green et al (1944)15, y se calcula al dividir la cara en cuatro áreas: la frente (f), el área malar derecha (md), el área malar izquierda (mi) y el mentón (m). Cada área es medida considerando que la frente, el área malar derecha e izquierda representan un 30% cada una, y el mentón un 10% de la superficie total de la cara16. La puntuación MASI se calcula mediante la evaluación subjetiva de 3 factores: área involucrada (A), densidad de la pigmentación (D), y homogeneidad de la distribución del pigmento (H) (Figura 1).
Evolución
El melasma puede desaparecer espontáneamente en un período de meses tras el parto o la interrupción del consumo de anticonceptivos17, y en casos raros remite lentamente después de evitar la exposición al sol9.
Tratamiento
La estrategia de tratamiento comprende tres líneas de intervención18,19:
- Agentes tópicos despigmentantes, protectores solares de amplio espectro y camuflaje.
- Peelings químicos.
- Láser.
En el presente trabajo se ha optado por la aplicación de ATX mediante microinyección, puesto que estudios previos ya habían demostrado que las formas oral e intradérmica de aplicación del ATX son efectivas en el tratamiento del melasma.
Material y método
Se realizó un estudio prospectivo y observacional en pacientes con melasma mixto mediante tratamiento de mesoterapia con ATX al 5%.
En el estudio clínico se incluyeron voluntarios mayores de 18 años con fototipos II a V de Fitzpatrick, con melasma epidérmico o mixto, y sin alergias conocidas a los componentes del producto de estudio. Se realizó en los centros: Guillén de Castro (Atención primaria) y Clínica Cevallos (Medicina Estética y Antienvejecimiento) durante el período de agosto a octubre de 2018. El grupo de estudio inicial fueron 12 pacientes (1 hombre y 11 mujeres) con edades comprendidas entre 23 y 60 años (44,9 ± 6,35). Dos pacientes abandonaron el estudio por causas no relacionadas con el mismo; siendo 10 los participantes.
Se tuvieron en cuenta los siguientes criterios de inclusión: no padecer trastornos de la coagulación, aceptación firmada de pertenecer al protocolo de investigación y consentimiento informado de la aplicación de mesoterapia con ATX. Los pacientes presentaban melasma mixto, epidérmico y/o dérmico, y estaban diagnosticados desde hacía 2 años.
Se excluyeron aquellos pacientes portadores de enfermedades de tipo inmunológico, diabetes, psoriasis, hipertensión arterial, tromboembolismo pulmonar, antecedentes de convulsiones, insuficiencia renal. Asimismo, quedaron excluidas pacientes embarazadas o en proceso de lactancia.
Antes de iniciar el estudio se realizó la valoración MASI de cada paciente para determinar el grado de disminución del melasma al finalizar la séptima sesión de mesoterapia después de tres meses de tratamiento.
Protocolo de tratamiento
Todos los pacientes se trataron con el mismo protocolo:
- Ácido tranexámico al 5% en viales de 5 ml (Amchafibrin ®, Biologici Italia Laboratorie, Masate, Italia).
- Peeling de ácido mandélico al 15% y ácido salicílico al 15% en solución gel (Dermium Lab, Barcelona, España).
- Crema Hidrorrenovadora ISSEIMI (Heberfarma, Madrid, España).
- Serum despigmentante Blockmelan ISSEIMI (Heberfarma, Madrid, España).
- Crema con retinol (TimeWise Repair® Volu‑Firm) (Mary Kay Cosmetics, Texas, USA).
- Filtro solar Láser Sunscreen 100 (Wellness Cosmetics, Farmabetera, Valencia, España).
El tratamiento con ATX (500 mg / 5 ml) se realizó en 7 sesiones de mesoterapia, previa limpieza de rostro con clorhexidina y aplicación de anestesia tópica EMLA entre 40‑60 minutos antes de aplicar las inyecciones. Se inyectó de 0,2 a 0,3 ml de ATX 5% sobre cada punto de mesoterapia, dejando un espacio de 1 cm entre cada punto aplicado. Las diluciones de 0,2 a 0,3 ml equivalen a 10 a 20 mg de ATX no diluido. Al final del procedimiento se aplicó la crema hidrorrenovadora.
Además, se realizaron tres peelings médicos, uno cada 30 días, intercalados con la mesoterapia. Se empleó ácido mandélico y salicílico, ambos al 15% en formulación gel, como parte del protocolo despigmentante.
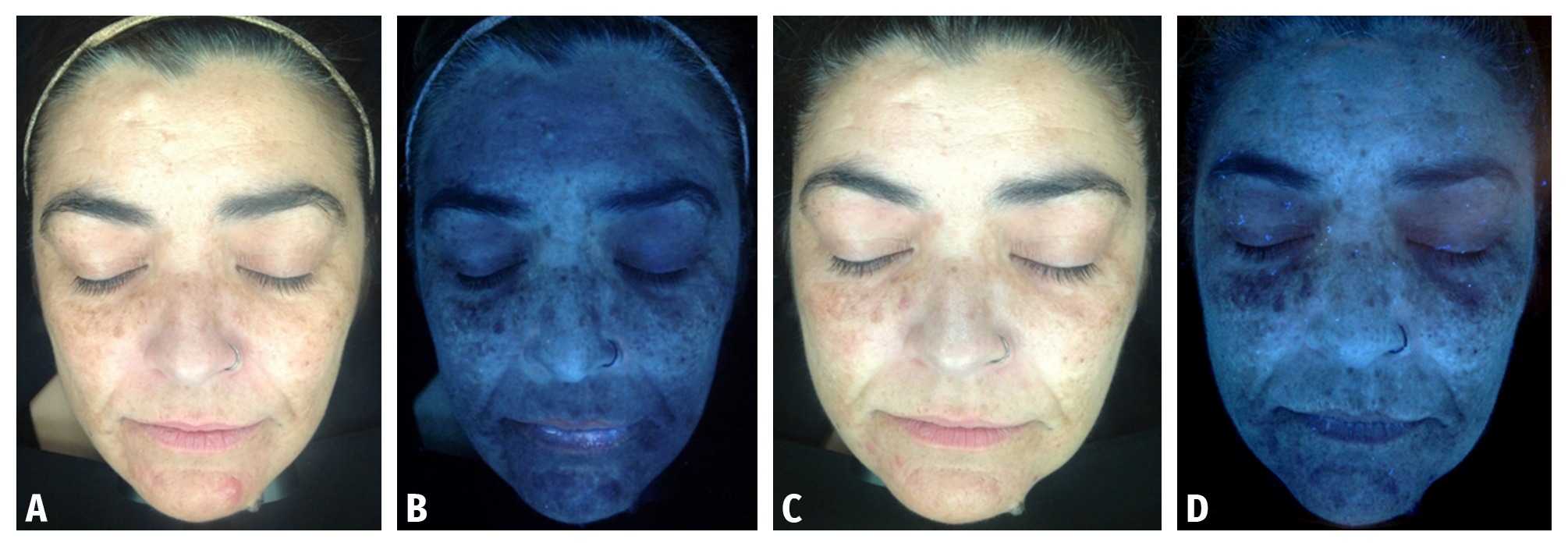
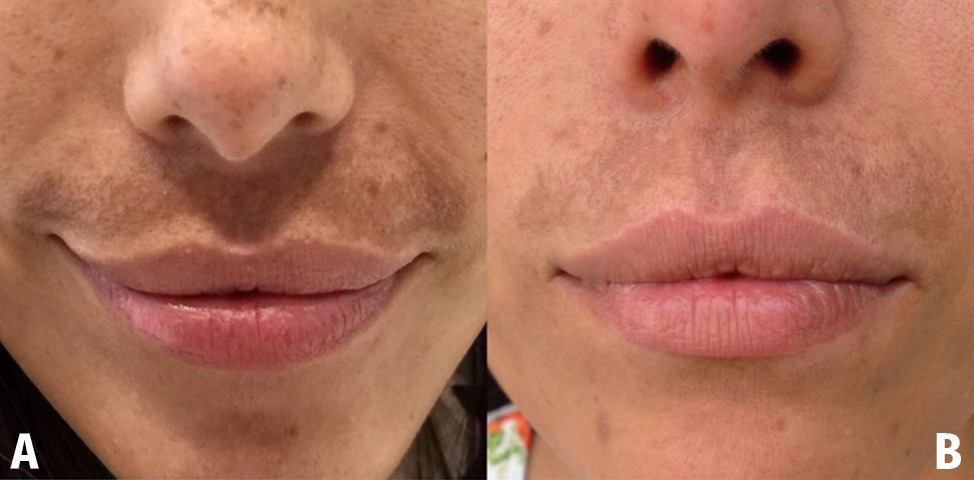
Se realizaron seis fotografías a cada uno de los pacientes con un analizador cutáneo, previo al inicio del tratamiento y un mes después de haber finalizado la última sesión de mesoterapia para valorar el grado de intensidad de pigmentación cutánea y medir su posible disminución.
Al protocolo de clínica se sumaron las siguientes especificaciones para el cuidado domiciliario, durante los tres meses de duración del estudio.
- Limpieza de la piel con un exfoliante suave, mañana y noche.
- Crema hidratante específica para cada tipo de piel (seca, mixta y grasa).
- Filtro solar 50+.
- Crema de retinol por la noche.
- Serum despigmentante, el cual se dejaba toda la noche sobre las zonas de mayor intensidad de la mancha.
Control del tratamiento
Para el adecuado control de tratamiento se empleó:
- Analizador cutáneo Observ 520 de la empresa SYLTON (InnoFaith beauty sciences, Eindhoven, Holanda).
- Toma de imágenes mediante iPad 4 (Apple Inc, California, Estados Unidos). Las imágenes se tomaron sin flash, con flash y con luz polarizada.
- Iconografía.
- MASI: mediante aplicación electrónica que calcula este valor teniendo en cuenta los parámetros de la escala MASI.
Estudio estadístico
Se utilizó el programa SPSS v. 20 para Windows. Se fijaron los intervalos de confianza y se realizó un análisis multivariante para muestras relacionadas (t de Student). Se consideró un valor de p < 0,05 como estadísticamente significativo. Al tratarse de una muestra pequeña también se ha realizado el test no paramétrico de Wilcoxon.
Resultados
Los 10 pacientes completaron 7 sesiones de mesoterapia, 3 sesiones de peelings y los protocolos de cuidado de la piel fuera de consulta, observándose una disminución importante del índice de MASI (Figuras 2-5).
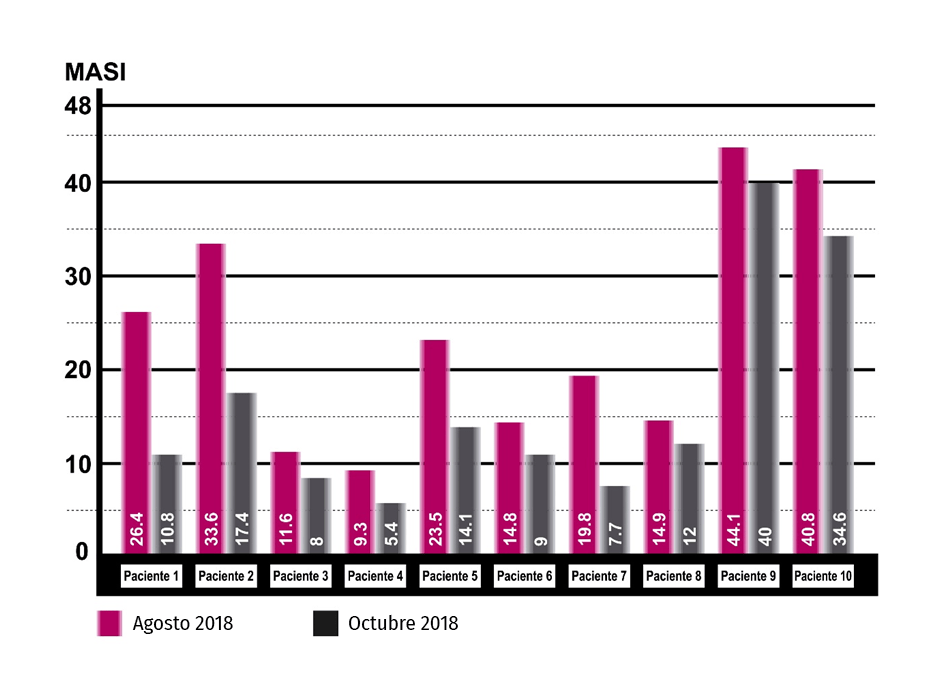
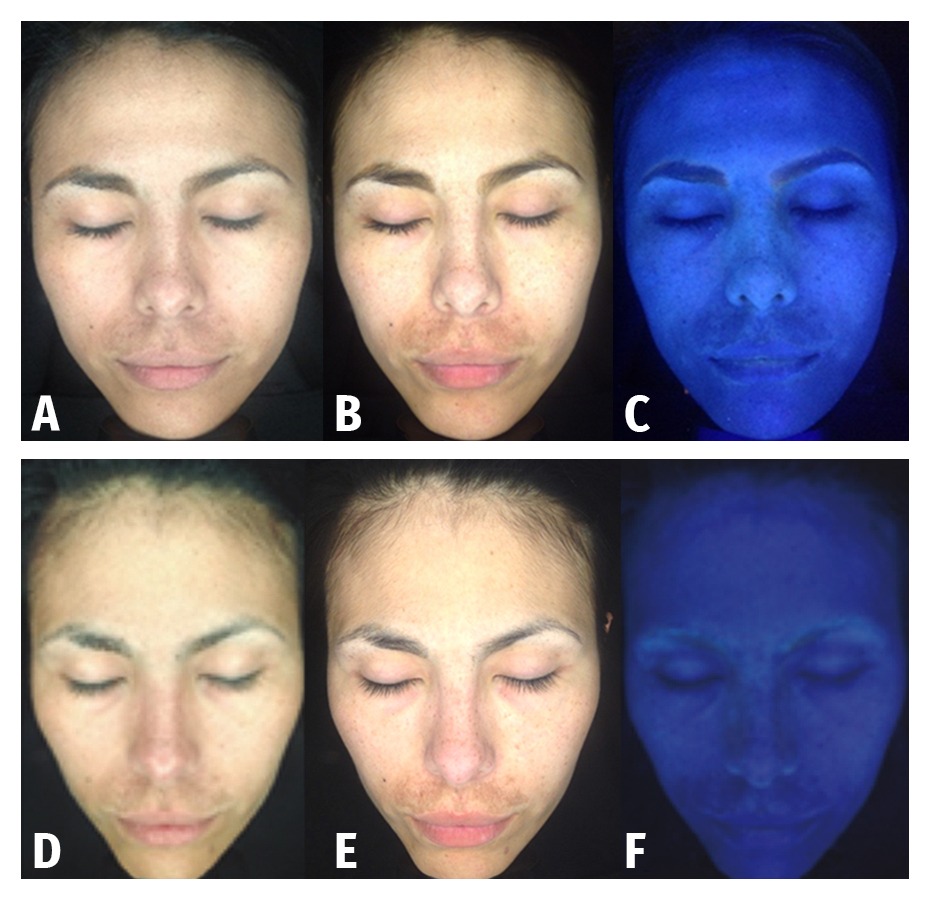
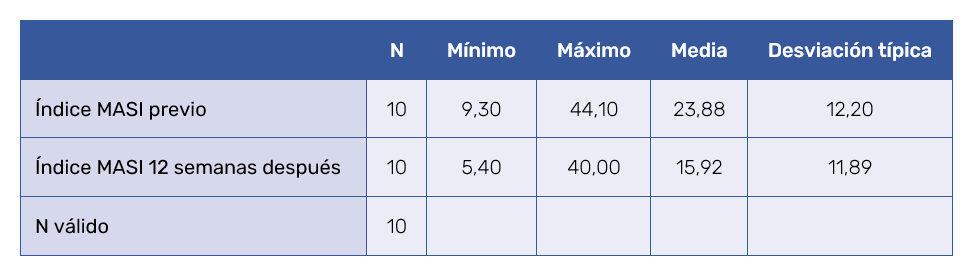
La pigmentación del melasma en los 10 pacientes tratados, según el MASI, disminuyó de 23,88 ± 12,2 (rango: 9,3 – 44,1) antes del tratamiento a 15,9 ± 11,9 (rango: 5,4 – 40) después del mismo (Tabla I). La diferencia entre medias (T de Student) fue significativa (7,96 ± 5,06) con valor de p < 0,05. El test de Wilcoxon o de rangos con signos de muestras relacionadas, igualmente arrojó un valor significativo (p < 0,05) sobre la diferencia de medianas de antes y después del tratamiento.
Los efectos secundarios observados tras el tratamiento mesoterápico fueron:
- Eritema en el punto de inyección. Los pacientes comunicaron su desaparición antes de las primeras 24 horas.
- Ardor inmediatamente después de la infiltración de ATX, que duró unos pocos minutos.
- Equimosis leve en el punto de inyección que desapareció entre 4 y 7 días después.
El empleo por parte de los pacientes de las recomendaciones cosméticas domiciliarias fue bien tolerado y no se informó de efecto adverso alguno. Asimismo, tampoco hubo efectos adversos destacables después de la aplicación de los 3 peelings previstos, salvo eritema y leve escozor, ambos poco significativos.
Discusión
El melasma es una patología multifactorial que debería ser abordada combinando diferentes tratamientos. Los tratamientos convencionales descritos en la literatura, como despigmentantes (formato cosmético), peelings químicos y/o láser, no están exentos de efectos secundarios, incluyendo la aparición de HPI20.
Eunice Del Rosario et al, realizaron un estudio en 44 pacientes, con melasma de moderado a severo. El estudio contempló 2 grupos de tratamiento: un grupo fue tratado durante 3 meses con 250 mg de ATX por vía oral; el grupo de control recibió cápsulas iguales con placebo dos veces al día. Ambos grupos emplearon el mismo protector solar. Como resultado de este estudio hubo una reducción de la puntuación MASI de 49% en el grupo que tomó ATX, frente al 18% del grupo de control. Los pacientes con melasma severo mejoraron más que aquellos con melasma moderado. No se observaron eventos adversos relevantes en ninguno de los grupos21.
Wei Min et al, recomiendan no administrar ATX por vía oral para una indicación cosmética (aunque sea en dosis bajas) a pacientes con comorbilidades trombofílicas, incluyendo también aquellos con diabetes mellitus, accidentes cerebrovasculares, cardiopatía isquémica y coagulopatías; los pacientes que no tienen antecedentes de eventos trombóticos o hipercoagulabilidad se consideran de bajo riesgo, pero se les debe informar de la relación riesgo beneficio antes de comenzar el tratamiento22.
En relación con lo anterior, sería preferible realizar la administración de ATX mediante mesoterapia. Esta recomendación como primera opción, antes de recomendar el tratamiento por vía oral en los pacientes, obtiene una reducción estadísticamente significativa en el MASI a las 12 semanas de tratamiento1. Por lo tanto, en pacientes en quienes esté contraindicada la toma de este fármaco puede representar una opción terapéutica eficaz23; no obstante, se requieren estudios adicionales para determinar si la vía mesoterápica está exenta de riesgos. También serían buenos candidatos aquellos pacientes en los que la terapia tópica o el láser se hayan mostrado ineficaces o provocado una HPI secundaria al tratamiento20,24.
Sirithanabadeekul et al, concluyen en su estudio que una única inyección intradérmica de ATX, a dosis de 50 mg/ml, redujo el riesgo general de HPI al remover lentigos. Este método de tratamiento causó efectos secundarios mínimos que no requirieron ninguna intervención terapéutica posterior. Por lo tanto, las inyecciones intradérmicas de ATX podrían ser un nuevo tratamiento que minimice el riesgo de HPI después del tratamiento con láser QS Nd:YAG, en 532 nm de emisión, sobre lentigos solares24. En ese sentido, el tratamiento propuesto podría formar parte de un protocolo destinado a evitar la HPI, cuando está prevista la inclusión de terapias basadas en láser o fuentes de luz.
Lee JH et al, en un estudio con 85 pacientes, observaron una disminución significativa (p < 0,05) en el MASI desde el inicio hasta las semanas 8ª y 12ª de tratamiento con microinyecciones intralesionales de ATX (13,22 +/‑ 3,02 vs 9,02 +/‑ 2,62 en la 8ª semana, y 7,57 +/‑ 2,54 en la 12ª semana, respectivamente). Concluyeron que esta modalidad terapéutica, potencialmente nueva, era efectiva y segura para el tratamiento del melasma23.
En todos los estudios realizados con mesoterapia, que se han consultado, se observa una disminución del grado de melasma, acorde con el resultado obtenido en nuestro estudio. Consideramos que puede utilizarse como una estrategia terapéutica, especialmente indicada en aquellos pacientes que no toleren el ATX vía oral o presenten una contraindicación a la toma de este fármaco.
Conclusiones
La mesoterapia con ATX, combinada con peelings poco agresivos, junto al empleo de una cosmética domiciliaria adecuada, disminuye la intensidad de la pigmentación del melasma (MASI) de modo significativo, en un tiempo breve y con pocos efectos adversos.
Son necesarios más estudios, con un mayor número de pacientes unido a un tiempo de observación más largo, para dejar bien establecido la contribución que representa la aplicación del ATX por vía mesoterápica en el conjunto del tratamiento combinado del melasma.
Conflicto de intereses
Las autoras manifiestan que no existe ningún conflicto de intereses (económico, profesional o personal) real, potencial o potencialmente percibido que pueda resultar en un sesgo en la publicación de este trabajo.
Bibliografía
- Sharma R, Mahajan VK, Mehta KS, Chauhan PS, Rawat R, Shiny TN. Therapeutic efficacy and safety of oral tranexamic acid and that of tranexamic acid local infiltration with microinjections in patients with melasma: a comparative study. Clin Exp Dermatol. 2017;42(7):728‑734. https://doi.org/10.1111/ced.13164
- Rivas S, Pandya AG. Treatment of melasma with topical agents, peels and lasers: an evidence-based review. Am J Clin Dermatol. 2013;14(5):359‑76. https://doi.org/10.1007/s40257-013-0038-4
- Ogbechie-Godec OA, Elbuluk N. Melasma: an Up-to-Date Comprehensive Review. Dermatol Ther (Heidelb). 2017;7(3):305‑318. https://doi.org/10.1007/s13555-017-0194-1
- Taraz M, Niknam S, Ehsani AH. Tranexamic acid in treatment of melasma: A comprehensive review of clinical studies. Dermatol Ther. 2017;30(3). https://doi.org/10.1111/dth.12465
- Aamir S, Naseem R. Oral tranexamic acid in treatment of melasma in Pakistani population: a pilot study. Journal of Pakistan Association of Dermatology. 2016; 24(3):198‑203.
- Lee HC, Thng TG, Goh CL. Oral tranexamic acid (TA) in the treatment of melasma: A retrospective analysis. J Am Acad Dermatol. 2016; 75(2):385‑92. https://doi.org/10.1016/j.jaad.2016.03.001
- Lee JH, Park JG, Lim SH, Kim JY, Ahn KY, Kim MY, Park YM. Localized intradermal microinjection of tranexamic acid for treatment of melasma in Asian patients: a preliminary clinical trial. Dermatol Surg. 2006;32(5):626‑31. https://doi.org/10.1111/j.1524-4725.2006.32133.x
- Handel AC, Miot LD, Miot HA. Melasma: a clinical and epidemiological review. An Bras Dermatol. 2014;89(5):771‑82. https://doi.org/10.1590/abd1806-4841.20143063
- Lapeere H, Boone B, De Shepper S, Verhaeghe et al. Hipomelanosis e hipermelanosis. In Lowell A, Fitzpatrick G. Dermatología en Medicina General. Tomo I. 8ª ed. México. Editorial Médica Panamericana; 2014. p. 819‑820.
- Tse TW, Hui E. Tranexamic acid: an important adjuvant in the treatment of melasma. J Cosmet Dermatol. 2013;12(1):57‑66. https://doi.org/10.1111/jocd.12026
- Bagherani N, Gianfaldon, S, Smoller B. An overview on melasma. Pigmentary disorders. 2015; 2(10):218. https://doi.org/10.4172/2376-0427.1000216
- Pandya A, Berneburg M, Ortonne JP, Picardo M. Guidelines for clinical trials in melasma. Pigmentation Disorders Academy. Br J Dermatol. 2006;156 Suppl 1:21‑8. https://doi.org/10.1111/j.1365-2133.2006.07590.x
- Balkrishnan R, McMichael AJ, Camacho FT, Saltzberg F, Housman TS, Grummer S, Feldman SR, Chren MM. Development and validation of a health-related quality of life instrument for women with melasma. Br J Dermatol. 2003;149(3):572‑7. https://doi.org/10.1046/j.1365-2133.2003.05419.x
- Cestari TF, Hexsel D, Viegas ML, Azulay L, Hassun K, Almeida AR, Rêgo VR, Mendes AM, Filho JW, Junqueira H. Validation of a melasma quality of life questionnaire for Brazilian Portuguese language: the MelasQoL-BP study and improvement of QoL of melasma patients after triple combination therapy. Br J Dermatol. 2006;156 Suppl 1:13‑20. https://doi.org/10.1111/j.1365-2133.2006.07591.x
- Kimbrough-Green CK, Griffiths CE, Finkel LJ, Hamilton TA, Bulengo-Ransby SM, Ellis CN, Voorhees JJ. Topical retinoic acid (tretinoin) for melasma in black patients. A vehicle-controlled clinical trial. Arch Dermatol. 1994; 130(6):727‑33.
- Tomb RR, Nassar JS. Profil des pathologies cutanées observées en clinique dermatologique (1995‑2000) [Profile of skin diseases observed in a department of dermatology (1995‑2000)]. J Med Liban. 2000; 48(5):302‑9. French.
- Kang HY, Valerio L, Bahadoran P, Ortonne JP. The role of topical retinoids in the treatment of pigmentary disorders: an evidence-based review. Am J Clin Dermatol. 2009;10(4):251‑60. https://doi.org/10.2165/00128071-200910040-00005
- Shankar K, Godse K, Aurangabadkar S, Lahiri K, Mysore V, Ganjoo A, Vedamurty M, Kohli M, Sharad J, Kadhe G, Ahirrao P, Narayanan V, Motlekar SA. Evidence-based treatment for melasma: expert opinion and a review. Dermatol Ther (Heidelb). 2014; 4(2):165‑86. https://doi.org/10.1007/s13555-014-0064-z
- Kato H, Araki J, Eto H, Doi K, Hirai R, Kuno S, Higashino T, Yoshimura K. A prospective randomized controlled study of oral tranexamic acid for preventing postinflammatory hyperpigmentation after Q‑switched ruby laser. Dermatol Surg. 2011;37(5):605‑10. https://doi.org/10.1111/j.1524-4725.2011.01957.x
- Del Rosario E, Florez-Pollack S, Zapata L Jr, Hernandez K, Tovar-Garza A, Rodrigues M, Hynan LS, Pandya AG. Randomized, placebo-controlled, double-blind study of oral tranexamic acid in the treatment of moderate-to-severe melasma. J Am Acad Dermatol. 2018;78(2):363‑369. https://doi.org/10.1016/j.jaad.2017.09.053
- Tan AWM, Sen P, Chua SH, Goh BK. Oral tranexamic acid lightens refractory melasma. Australas J Dermatol. 2017; 58(3):e105‑e108. https://doi.org/10.1111/ajd.12474
- Ebrahimi B, Naeini FF. Topical tranexamic acid as a promising treatment for melasma. J Res Med Sci. 2014 Aug;19(8):753‑7.
- Sirithanabadeekul P, Srieakpanit R. Intradermal tranexamic acid injections to prevent post-inflammatory hyperpigmentation after solar lentigo removal with a Q‑switched 532‑nm Nd:YAG laser. J Cosmet Laser Ther. 2018; 20(7‑8):398‑404. https://doi.org/10.1080/14764172.2018.1444770
- Saki N, Darayesh M, Heiran A. Comparing the efficacy of topical hydroquinone 2% versus intradermal tranexamic acid microinjections in treating melasma: a split‑face controlled trial. J Dermatolog Treat. 2018; 29(4):405‑410. https://doi.org/10.1080/09546634.2017.1392476
- Arellano-Mendoza I, Arias-Gómez I, Barba-Gómez JF, Elizondo-Rodríguez A, García-Vargas A, Garza-Buentello E, Rodríguez-Castellanos MA. Melasma: Consenso del Grupo Mexicano para el Estudio de los Trastornos Pigmentarios. Dermatología Cosmética, Médica y Quirúrgica. 2007; 5(2): 112‑22.

