Complicaciones de la mesoterapia
informadas por la comunidad médica
internacional: alerta de los riesgos
del intrusismo para la salud pública.
Revisión sistemática
Introducción
Las sociedades científicas definen con el término de “mesoterapia” o “intradermoterapia” a una forma de tratamiento médico inyectivo alopático, intradérmico y locorregional. El objetivo es traspasar la barrera dermo-epidérmica para depositar localmente en la dermis (mesodermo) pequeñas dosis de fármacos, sobre superficies corporales poco extensas, pero en cantidad suficiente para obtener un efecto terapéutico1‑3.
Se considera una técnica inyectiva de aplicación exclusivamente médica, ya que se produce una rotura de la barrera dérmica empleando pequeñas agujas, cánulas o micropunciones asistidas por aparatos (dermo-rollers o dermapen), para introducir fármacos y productos en la piel. Las inyecciones pueden hacerse manualmente (unidad mano-jeringa-aguja) o asistidas (pistolas automáticas, pens dosificadores de punción o inyectores a presión tipo dermo‑jet). Las sustancias inyectadas incluyen antibióticos, antiinflamatorios no esteroideos, corticoides, analgésicos, vasodilatadores, flebotónicos, inmunomoduladores, vitaminas, productos homeopáticos y otros tipos de moléculas y principios activos. La mayoría de los fármacos de los grupos anteriores tienen un comportamiento bien conocido a nivel farmacológico y se encuentran autorizados para uso médico1‑5.
No existe acuerdo en cuanto a la eficacia de la mesoterapia; una parte de la comunidad científica se opone a este tipo de tratamientos debido a la falta de estudios suficientemente controlados. La otra parte, cuenta con el apoyo de publicaciones con resultados favorables y con el hecho de que un amplio número de médicos en todo el mundo emplean la mesoterapia con eficiencia y con resultados clínicos positivos. Evidentemente, su eficacia no solo depende de la técnica en sí, sino de los fármacos aplicados, su indicación y finalidad. El hecho es que la mesoterapia médica se encuentra en expansión desde que se inició la técnica en Francia a principios de la década de 19502,3.
En buena medida la mesoterapia se ha desarrollado en base a sus aplicaciones en Medicina Estética. La Sociedad Española de Medicina Estética (SEME), junto a otras sociedades médicas análogas del resto de países de la Unión Europea, defiende la eficacia y seguridad de la mesoterapia en determinadas indicaciones. No obstante, se insiste en que ninguno de los productos inyectados, ni las propias técnicas de inyección, están exentos de riesgos. Se conocen complicaciones graves, como las infecciones por micobacterias atípicas, alopecia irreversible y cicatricial en determinados pacientes o eventuales reacciones sistémicas que requieren una intervención inmediata. Se necesita una formación médica especializada, tanto para la aplicación eficiente de la mesoterapia como para identificar y tratar a tiempo potenciales complicaciones que, desafortunadamente, pueden suceder incluso en manos expertas.
Material y método
La búsqueda y selección de artículos se llevó a cabo por dos expertos en documentación médica, siguiendo las recomendaciones para una revisión sistemática6‑9. Se ejecutó un vaciado de la información en la base de datos MEDLINE, con una búsqueda accesoria en Google Académico. Se utilizaron las palabras: mesotherapy, intradermotherapy, microinjection, safety, side effect y complication, bajo distintas estrategias de cruces y rastreos complementarios por nombres de autores. De las opciones ensayadas, la más productiva fue la lectura de todos los títulos y resúmenes encontrados a partir de la palabra clave “mesotherapy”, que incluía 196 entradas en MEDLINE en el momento de la búsqueda (julio de 2016). El grado de concordancia en la selección independiente de artículos, por parte de ambos expertos, se evaluó mediante el Coeficiente Kappa de Cohen. La selección adicional a través de Google Académico se realizó conjuntamente, por consenso, y fue poco productiva para obtener información adicional de suficiente rigor científico. Los artículos seleccionados se ordenaron cronológicamente desde el más antiguo hasta el más reciente para facilitar una visión histórica de los diferentes sucesos adversos que se han ido comunicando. Para la explotación de los datos se consideraron aspectos básicos: 1) tipos y categorías de artículos, 2) procedencia de autores y pacientes, 3) tipo de riesgo, complicación o efecto adverso acontecido, 4) número de casos registrados y 5) aspectos más destacados de cada artículo para posibilitar una posterior valoración conjunta.
Resultados
Se encontró una buena concordancia en la selección de publicaciones por parte de ambos expertos (Coeficiente Kappa de Cohen=0,86). Se obtuvieron 53 artículos con información original bien documentada10‑62. Se excluyeron dos publicaciones que parecían incluir los mismos casos, con distintos enfoques, en dos revistas diferentes y que ya habían sido incluidas previamente. De los 53 artículos, 34 correspondieron a casos clínicos únicos (case report, cartas al editor o comentarios de varios casos, con sólo uno bien aclarado), 9 artículos fueron series cortas de casos de entre 2 y 14 pacientes y 10 artículos eran estudios clínicos con muestras de 15 o más pacientes. Nueve estudios clínicos eran casuísticas retrospectivas, bien estudiadas, sobre brotes de infecciones de micobacterias atípicas secundarios a la mesoterapia. El estudio clínico restante era un ensayo piloto sobre eficacia, con efectos adversos escasos y poco relevantes. No se encontraron ensayos clínicos aleatorizados y controlados con efectos adversos.
Los estudios clínicos con más de 15 casos tenían en común ser brotes prevenibles de micobacterias no tuberculosas, propagados por mesoterapia. Por ello, el concepto BEMPAM ocupa una parte central en este estudio. En la Tabla I se muestran cronológicamente los datos fundamentales de los estudios analizados. Las referencias encontradas se extendían a lo largo del período comprendido entre 1984 y 2016, siendo más frecuentes las aparecidas a partir del año 2005, de tal modo que más de la mitad de las citas eran posteriores al 2008.
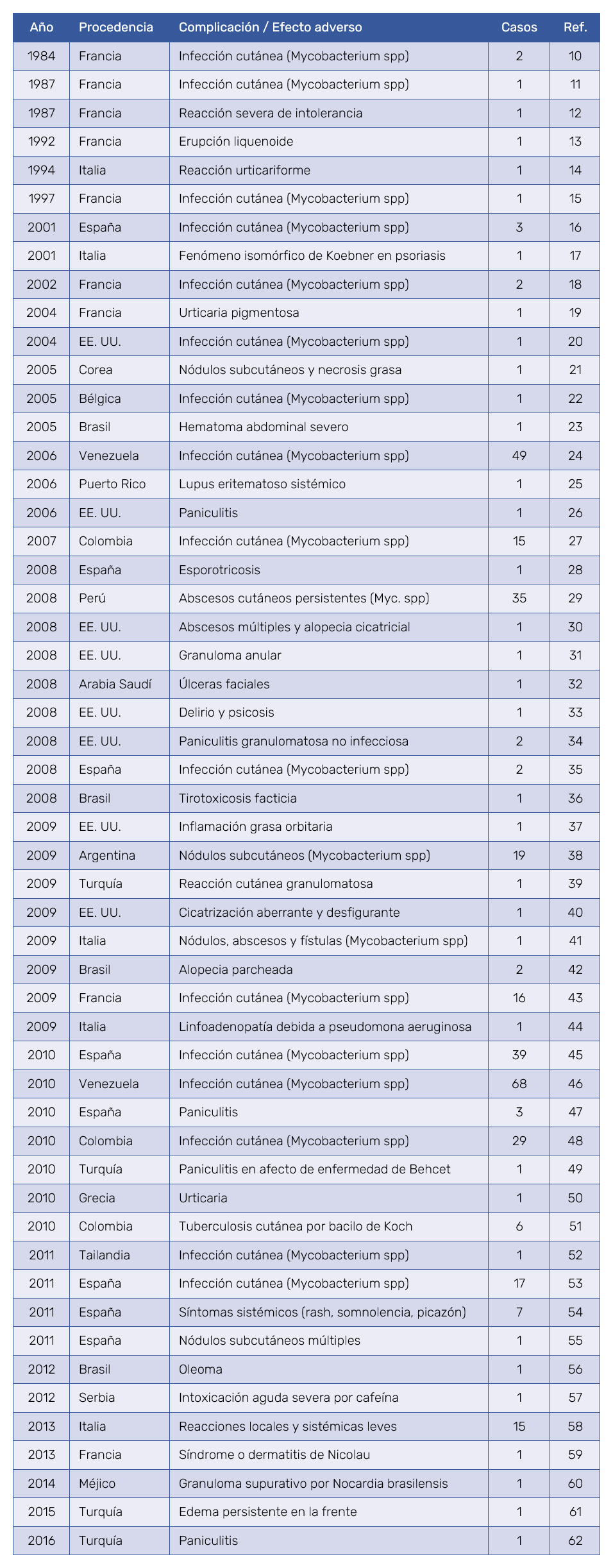
La mesoterapia se practica en gran parte del contexto internacional y las alarmas sobre efectos adversos proceden de muy diversas localizaciones geográficas. Los casos iniciales procedían de Francia y, posteriormente, de otros países de la Unión Europea como España e Italia. Los brotes de infecciones por micobacterias atípicas se han comunicado en Latinoamérica y en la Europa Mediterránea. No se han comunicado casos de efectos adversos desde países anglosajones, excepto casos aislados en EE. UU.
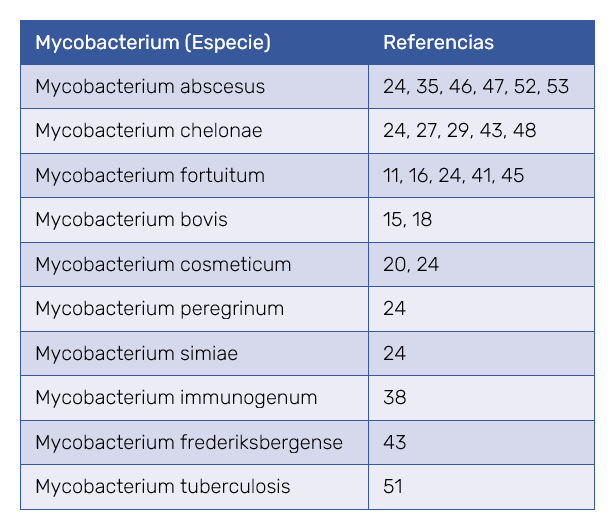
La complicación mejor documentada de la mesoterapia es la infección por micobacterias atípicas no tuberculosas, agresivas y de difícil tratamiento. Pueden provocar afectaciones graves de la piel y del tejido celular subcutáneo, con nódulos, abscesos, fístulas y cicatrices residuales, especialmente en áreas de intervención estética como el abdomen y las caderas10,11,15,16,18,20,22,24,27,29, 35,38,41,43,45,46,48,52,53. En la Tabla II se indican las especies de micobacterias que se han aislado a partir de lesiones secundarias a mesoterapia, destacando especialmente M. abscesus, M. chelonae y M. fortuitum24,27,29,35,43,46‑48,52,53. También se han confirmado casos de tuberculosis cutánea por Mycobacterium tuberculosis51. Las infecciones no micobacterianas incluyen esporotricosis28 y pseudomona44, entre otras. Las afectaciones del tejido subcutáneo, de causa infecciosa o no infecciosa, incluyen nódulos, granulomas, paniculitis, necrosis grasa, y oleomas, entre otras. Los artículos originales mostraban fotografías demostrativas y especifican los detalles de cada caso.
Las complicaciones de la mesoterapia en los tratamientos capilares también son diversas. Por ejemplo, el edema persistente de la frente tras mesoterapia con minoxidil61, o casos de peor pronóstico como los abscesos multifocales con necrosis grasa subcutánea y alopecia cicatricial30. Algunas sustancias inyectadas incluyen mezclas de extractos naturales de plantas, productos homeopáticos, vitaminas, vasodilatadores, finasteride y minoxidil. Duque-Estrada (2009) describió un caso de alopecia cicatricial inyectando únicamente agentes homeopáticos42.
Aunque uno de los objetivos de la mesoterapia es evitar las complicaciones sistémicas asociadas a los fármacos, algunos casos de mesoterapia han provocado alteraciones generalizadas. Entre las descritas destacan casos de debilidad, erupciones, somnolencia y picazón54, urticaria50, lupus eritematoso sistémico25, delirio y psicosis33, tirotoxicosis facticia36 e intoxicación por cafeína57.
Respecto a los nueve estudios sobre BEMPAM24,27,29,38,43,45,46,48,53 se obtuvieron los siguientes resultados:
- Se comprueba la existencia de brotes epidémicos de micobacterias atípicas no tuberculosas, después de tratamientos con mesoterapia, con relación causa-efecto demostrada, en los siguientes países, por orden cronológico de publicación: Venezuela24,46, Colombia27,29, Perú29, Argentina38, Francia43 y España17,45. España es el país europeo con más casos conocidos en estos brotes.
- El motivo del tratamiento mesoterápico era reducir la celulitis o la obesidad localizada.
- Los productos inyectados generalmente eran desconocidos, productos de tipo homeopático o sustancias no autorizadas. En Venezuela una de las sustancias más utilizadas se conoce con el nombre de “Lipoescultor” y contiene plantas, algas, minerales y sales, usadas habitualmente en homeopatía.
- Las características de las lesiones fueron comunes en todos los estudios (granulomas, abscesos y úlceras) sin respuesta al tratamiento antibiótico.
- Las lesiones se localizaron en los sitios de punción, generalmente abdomen, caderas, glúteos y piernas, en forma de abscesos y úlceras supurativas.
- Los análisis de laboratorio dieron positivos para micobacterias, aislándose frecuentemente la especie (enumeradas en la Tabla II).
- En los casos en que se finalizaron las investigaciones se demostró el uso de productos contaminados o fallos en las medidas de higiene elementales.
- En general los pacientes habían acudido a un mismo centro y se les había aplicado el mismo producto.
- En la mayoría de casos el terapeuta siempre fue el mismo.
- En los estudios de epidemiología molecular de las micobacterias todos los pacientes tenían una misma fuente de infección, que no procedía del ambiente.
- Muchos autores indican que es necesario intervenir porque persiste el riesgo de nuevos brotes.
Discusión
La principal limitación de este estudio fue la probable omisión de información válida sobre otras complicaciones no contenidas en la base de datos MEDLINE. No obstante, este estudio es el más amplio e informado sobre complicaciones hasta la fecha.
Las complicaciones de la mesoterapia son un problema de plena actualidad, más si se tiene en cuenta que la mayoría de ellas se vienen observando desde 2008. Los productos inyectados, incluyendo los homeopáticos, pueden provocar reacciones adversas, localizadas o sistémicas, de muy diferentes tipos, en casos aislados. Las complicaciones, muy excepcionalmente, pueden aparecer en condiciones ideales de aplicación, en función de la idiosincrasia o hipersensibilidad del paciente. Estos casos difícilmente se pueden prevenir, por lo que es importante valorar el beneficio/riesgo de las intervenciones mesoterápicas. Mención aparte merecen los BEMPAM y la mayoría de efectos adversos, sobre los que se debe actuar, porque son consecuencia de utilizar productos no autorizados, probablemente mal esterilizados y/o de la falta de asepsia/antisepsia en alguno o varios pasos de la aplicación de la técnica. Otras adversidades se deben a la aplicación de productos no indicados en pacientes con determinados antecedentes o a sobredosificaciones de productos inyectados por falta de formación y de una buena técnica.
En Latinoamérica y en la Europa Mediterránea la mesoterapia se utiliza habitualmente para tratar afecciones cutáneas y condiciones estéticas como queloides, alopecia areata y difusa, y especialmente para la celulitis y la obesidad localizada. Muchas veces los médicos que atienden las complicaciones de los pacientes no son los terapeutas que han aplicado la mesoterapia: desconocen los productos que se han inyectado y acaban inmersos en una investigación particular que se dificulta cuando los que han realizado la intervención no son médicos.
En el caso de los países latinoamericanos, las sustancias inyectadas con mayor frecuencia incluyen vasodilatadores, lipolíticos (L‑carnitina, aminofilina), minerales, vitaminas y extractos naturales de plantas (alcachofa, centella asiática) solos o combinados con anestésicos locales (lidocaína o procaína)24. Venezuela es el país con más casos comunicados. Los terapeutas son médicos, cosmetólogos y personas sin licencia24. Muchos productos que se inyectan no están sometidos a controles de calidad. Los médicos venezolanos han investigado a fondo los BEMPAM, tanto la clínica como la epidemiología genético-molecular de las micobacterias24,46. También han suscitado el interés del CDC en referencia al Mycobacterium cosmeticum, especie aislada e identificada por primera vez a partir de una infección cutánea post-mesoterapia en una paciente venezolana20. La experiencia clínica en Venezuela con las micobacterias atípicas la describieron Rivera Olivero et al (2006), haciendo énfasis en las dificultades y el retraso en el diagnóstico definitivo que encontraron los pacientes, así como el retraso en el diagnóstico microbiológico, el tratamiento y el seguimiento de los mismos. Además, advierte en contra de esta práctica, especialmente cuando se realiza de manera inadecuada en ambientes no aptos, con productos sin permiso sanitario y con terapeutas no cualificados24. Lo mismo indicó Da Mata Jardín et al (2010), que fue la primera autora en describir la esencia de los BEMPAM a nivel clínico y de laboratorio46.
En febrero de 2005, cuando todavía no se conocían casos de BEMPAM, el Departamento de Salud de Virginia (EE. UU.) y el CDC notificaron un brote de reacciones cutáneas adversas secundarias a tratamientos de mesoterapia llevados a cabo por un terapeuta sin titulación médica en el distrito de Columbia (EE. UU.). Se efectuó una investigación entrevistando a 20 afectados, 16 de ellos indicaron reacciones adversas en uno o más sitios de inyección; en 14 casos los efectos adversos duraron más de tres días y en 11 de ellos todavía presentaban las lesiones en el momento de la entrevista. Dichas lesiones consistían en enrojecimiento, hinchazón y, en algunos casos, úlceras. A partir de las entrevistas se constató que las intervenciones se llevaron a cabo con fallo en la higiene de manos, fallo al no desinfectar la piel con un antiséptico y fallo en la no utilización de guantes. Los pacientes indicaban que la sustancia inyectada contenía extractos de plantas, líquido de graphites, procaína y otras sustancias. Salvo la procaína, ninguna de las sustancias mencionadas por los afectados se encontraba autorizada por la FDA para la inyección subcutánea. Sólo se pudieron obtener muestras de lesiones en pocos pacientes y los cultivos de laboratorio no fueron concluyentes. En aquel momento no se pudo localizar al terapeuta63. Con la experiencia actual, las características clínicas y epidemiológicas del caso sugieren que debió tratarse de un BEMPAM.
Conclusión
Cada año se practican en el mundo miles de procedimientos mesoterápicos con resultados satisfactorios y eficaces. La experiencia de varias décadas demuestra un balance beneficio/riesgo favorable, con resultados claramente satisfactorios en un contexto integral de tratamiento. Estos motivos explican que la técnica se encuentre en pleno auge y que el interés médico por la mesoterapia sea también creciente en base a la experiencia clínica acumulada. La inmensa mayoría de los efectos adversos aquí descritos podrían haberse evitado seleccionando mejor los casos intervenidos, evitando sobredosificaciones y evitando fallos técnicos. El intrusismo del personal no médico en la aplicación de estos tratamientos, cada vez más extendido (salones de belleza), desvirtúa esta modalidad terapéutica y pone en riesgo la salud de la comunidad. Las autoridades sanitarias y políticas tienen que mantener la alerta sobre los riesgos para la salud pública que implica la práctica de la mesoterapia sin las preceptivas medidas sanitarias de higiene y, muy especialmente, de formación. La mesoterapia con finalidad médico-estética debe ser de aplicación exclusivamente médica, pues la indicación y tratamiento, asegurar las medidas de asepsia durante las intervenciones y el abordaje de las posibles complicaciones, son todo ello actos médicos. En la misma línea se pronuncia la Sociedad Italiana de Mesoterapia, recordando que la aplicación de la mesoterapia requiere un diagnóstico clínico y un consentimiento informado, donde consten los potenciales beneficios, limitaciones y posibles riesgos, por leves que se prevean64,65. La SEME, junto a otras sociedades médicas europeas análogas, insisten en la necesidad de actuar contra los actos de intrusismo profesional de manera acorde a los potenciales daños que se pueden causar.
Agradecimientos
Queremos agradecer a todos los autores que han sido incluidos en el apartado de referencias, el tiempo y dedicación altruista en aportar sus respectivos casos, en beneficio de la ciencia médica y de la sociedad en general.
Bibliografía
- Seme.org [internet]. Mesoterapia. SEME; 2007 [actualizado febrero 2016; citado agosto 2016]. https://www.seme.org/pacientes/tecnicas-y-tratamientos/mesoterapia
- Semm.es [internet]. Qué es la mesoterapia. Valencia: SEMM 2013 [actualizado febrero 2013; citado agosto 2016].
- Simeso.org [internet]. Mesoterapia: objetivos. París: SIMESO 2008 [actualizado abril 2008; citado agosto 2016].
- Rotunda AM, Kolodney MS. Mesotherapy and phosphatiylcholine injections: historical clarification and review. Dermatol Surg. 2006; 32: 465‑480. https://doi.org/10.1111/j.1524-4725.2006.32100.x
- Sarkar R, Garg VK, Mysore V. Position paper on mesotherapy. Indian J Dermatol Venereol Leprol. 2011;77: 232‑7. https://doi.org/10.4103/0378-6323.77479
- Dickersin K, Scherer R, Lefevre C. Identifying relevant studies for systematic reviews. BMJ. 1994; 309: 1286‑1291. https://doi.org/10.1136/bmj.309.6964.1286
- Helmer D, Savoie I, Green C, Kazanjian A. Evidence-based practice: extending the search to find material for the systematic review. Bull Med Libr Assoc. 2001; 89: 346‑352.
- Soualmia LF, Dahamna B, Thirion B, Darmoni SJ. Strategies for health information retrieval. Stud Health Technol Inform. 2006; 124: 595‑600.
- Darmoni SJ, Thirion B, Leroyt JP, Douyère M, Lacoste B, Godard C, et al. A search tool based on “encapsulated” MeSH thesaurus to retrieve quality health resources on the internet. Med Inform Internet Med. 2001; 26: 165‑178. https://doi.org/10.1080/14639230110064488
- Guillaume JC, Jouffroy L, Touraine R. Complications cutanées de la mésothérapie (2 observations). Ann Dermatol Venereol. 1984; 111: 701‑702.
- Friedel J, Piémont Y, Truchetet F, Cattan E. Mesotherapy and cutaneous mycobacteriosis caused by Mycobacterium fortuitum: alternative medicine at risk. Ann Dermatol Venereol. 1987; 114: 845‑849.
- Didier A, Carre P, Rostin M, Leophonte P. Intolerance reaction after mesotherapy. Therapie. 1987; 42: 563‑564.
- Vaillant L, De Muret A, Muller C, Machet L, Lorette G. Lichenoid drug eruption after mesotherapy. Ann Dermatol Venereol. 1992; 119: 936‑937.
- Urbani CE. Urticarial reaction to ethylenediamine in aminophylline following mesotherapy. Contact dermatitis. 1994; 31: 198‑199. https://doi.org/10.1111/j.1600-0536.1994.tb01975.x
- Paul C, Burguiere AM, Vincent V, Susbielle P, Bonvalet D, Dubertret L. BCG‑induced mycobacterium infection induced by alternative medicine. Ann Dermatol Venereol. 1997; 124: 710‑712.
- Nagore E, Ramos P, Botella-Estrada R, Ramos-Níguez JA, Sanmartin O, Castejón P. Cutaneous infection with Mycobacterium fortuitum after localized microinjections (mesotherapy) treated successfully with a triple drug regimen. Acta Derm Venereol. 2001; 81: 291‑293. https://doi.org/10.1080/00015550152572967
- Rosina P, Chieregato C, Miccolis D, D'Onghia FS. Psoriasis and side-effects of mesotherapy. Int J Dermatol. 2001; 40(9): 581‑583. https://doi.org/10.1046/j.1365-4362.2001.01248-3.x
- Marco-Bonnet J, Beylot-Barry M, Texier-Maugein J. Barrucq JP, Supply P. Doutre MS. Beylot C. Mycobacterial bovis BCG cutaneous infections following mesotherapy: 2 cases. Ann Dermatol Venereol. 2002; 129: 728‑731.
- Bessis D, Guilhou JJ, Guillot B. Localized urticaria pigmentosa triggered by mesotherapy. Dermatology. 2004; 209: 343‑344. https://doi.org/10.1159/000080863
- Cooksey RC, de Waard JH, Yakrus MA, Rivera I, Chopite M, Toney SR, Morlock GP, Butler WR. Mycobacterium cosmeticum sp.nov., a novel rapidly growing species isolated from a cosmetic infection and from a nail salon. Int J Syst Evol Microbiol. 2004; 54: 2385‑2391. https://doi.org/10.1099/ijs.0.63238-0
- Lee DP, Chang SE. Subcutaneous nodules showing fat necrosis owing to mesotherapy. Dermatol Surg. 2005; 31: 250‑251. https://doi.org/10.1097/00042728-200502000-00027
- Henry F, Piérard-Franchimont C, Piérard GE. Clinical case of the month. Atypical mycobacteria and mesotherapy. Rev Med Liege. 2005; 60: 7‑10.
- Brandao C, Fernándes N, Mesquita N, Dinis-Ribeiro M, Silva R, Lomba Viana H, Moreira Dias L. Abdominal haematoma – a mesotherapy complication. Acta Derm Venereol. 2005; 85: 446. https://doi.org/10.1080/00015550510027829
- Rivera-Olivero IA, Guevara A, Escalona A, Oliver M, Pérez-Alfonzo R, Piquero J, Zerpa O, de Waard JH. Infecciones en tejidos blandos por micobacterias no tuberculosas secundarias a mesoterapia. ¿Cuánto vale la belleza? Enferm Infecc Microbiol Clin. 2006; 24: 302‑306. https://doi.org/10.1157/13089664
- Colón-Soto M, Peredo RA, Vilá LM. Systemic lupus erythematosus after mesotherapy with acetyl-L‑carnitine. J Clin Rheumatol. 2006; 12: 261‑262. https://doi.org/10.1097/01.rhu.0000239831.84504.0b
- Tan J, Rao B. Mesotherapy-induced panniculitis treated with dapsone: case report and review of reported adverse effects of mesotherapy. J Cutan Med Surg. 2006; 10: 92‑95. https://doi.org/10.2310/7750.2006.00013
- Sañudo A, Vallejo F, Sierra M, et al. Nontuberculous mycobacteria infection after mesotherapy: preliminary report of 15 cases. Int J Dermatol. 2007; 46: 649‑653. https://doi.org/10.1111/j.1365-4632.2007.02976.x
- Gamo R, Aguilar A, Cuétara M, González-Valle O, Houmani M, Martín L, Gallego MA. Sporotrichosis following mesotherapy for arthrosis. Acta Derm Venereol. 2007; 87: 430‑431. https://doi.org/10.2340/00015555-0271
- Munayco CV, Grijalva CG, Culqui DR et al. Outbreak of persistent cutaneous abscesses due to mycobacterium chelonae after mesotherapy sessions, Lima, Perú. Rev Saude Pública. 2008; 42: 146‑149. https://doi.org/10.1590/s0034-89102008000100020
- Kandry R, Hamadah I, Al-Issa A, Field L, Alrabia F. Multifocal scap abscess with subcutaneous fat necrosis and scarring alopecia as a complication of scalp mesotherapy. J Drugs Dermatol. 2008; 7: 72‑73.
- Strahan JE, Cohen JL, Chorni JA. Granuloma annulare as a complication of mesotherapy: a case report. Dermatol Surg 2008; 34: 836‑838. https://doi.org/10.1111/j.1524-4725.2008.34156.x
- Al-Khenaizan S. Facial cutaneous ulcers following mesotherapy. Dermatol Surg. 2008; 34: 832‑834. https://doi.org/10.1111/j.1524-4725.2008.34155.x
- Tor PC, Lee TS. Delirium with psychotic features possibly associated with mesotherapy. Psychosomatics. 2008; 49: 273‑274. https://doi.org/10.1176/appi.psy.49.3.273
- Davis MD, Wright TI, Shehan JM. A complication of mesotherapy: noninfectious granulomatous panniculitis. Arch Dermatol. 2008; 144: 808‑809. https://doi.org/10.1001/archderm.144.6.808
- García-Navarro X, Barnadas MA, Dalmau J, Coll P, Gurguí M, Alomar A. Mycobacterium abscessus infection secondary to mesotherapy. Clin Exp Dermatol. 2008; 33: 658‑659. https://doi.org/10.1111/j.1365-2230.2008.02869.x
- Danilovic DL, Bloise W, Knobel M, Marui S. Factitious thyrotoxicosis induced by mesotherapy: a case report. Thyroid. 2008; 18: 655‑657. https://doi.org/10.1089/thy.2007.0233
- Nabavi CB, Minckler DS, Tao JP. Histologic features of mesotherapy-induced orbital fat inflammation. Ophthal Plast Reconstr Surg. 2009; 25: 69‑70. https://doi.org/10.1097/iop.0b013e3181936456
- Del-Castillo M, Palmero D, López B. Mesotherapy-associated outbreak caused by Mycobacterium immunogenum. Emerg Infect Dis. 2009; 15: 357‑359. https://doi.org/10.3201/eid1502.081125
- Gokdemir G, Küçükünal A, Sakiz D. Cutaneous granulomatous reaction from mesotherapy. Dermatol Surg. 2009; 35: 291‑293. https://doi.org/10.1111/j.1524-4725.2008.01053.x
- Beer K, Waibel J. Disfiguring scarring following mesotherapy-associated Mycobacterium cosmeticum infection. J Drugs Dermatol. 2009; 8: 391‑393.
- Difonzo EM, Campanile GL, Vanzi L, Lotti L. Mesotherapy and cutaneous Mycobacterium fortuitum infection. Int J Dermatol. 2009; 48: 645‑647. https://doi.org/10.1111/j.1365-4632.2009.03487.x
- Duque-Estrada B, Vinceuzi C, Misciali C, Tosti A. Alopecia secondary to mesotherapy. J Am Acad Dermatol. 2009; 61: 707‑709. https://doi.org/10.1016/j.jaad.2008.11.896
- Regnier S, Cambau E, Meningaud JP, Guihot A, Deforges L, Carbonne A, Bricaire F, Caumes E. Clinical management of rapidly growing mycobacterial cutaneous infections in patients after mesotherapy. Clin Infect Dis. 2009; 49: 1358‑1364. https://doi.org/10.1086/606050
- Shaladi AM, Crestani F, Bocchi A, Saltari MR, Piva B, Tartari S. Cervical lymphoadenopathy due to Pseudomona aeruginosa following mesotherapy. Infez Med. 2009; 17: 169‑172.
- Quiñones C, Ramalle-Gómara E, Perucha M, Lezaun ME, Fernández-Vilariño E, García-Morrás P, Simal G. An outbreak of Mycobacterium fortuitum cutaneous infection associated with mesotherapy. J Eur Acad Dermatol Venereol. 2010; 24: 604‑606. https://doi.org/10.1111/j.1468-3083.2009.03461.x
- Da Mata Jardin O, Hernández-Pérez R, Corrales H, Cardoso-Leao S, de Waard JH. Follow up on an outbreak in Venezuela of soft-tissue infection due to Mycobacterium abscessus associated with mesotherapy. Enferm Infecc Microbiol Clin. 2010; 28: 596‑601. https://doi.org/10.1016/j.eimc.2009.08.003
- Gutiérrez-de la Peña J, Ruiz-Veramendi M, Montis-Suau A, Martín-Santiago A. Three cases of panniculitis due to Mycobacterium abscessus after mesotherapy. Actas Dermosifiliogr. 2010; 101:188‑190. https://doi.org/10.1016/j.ad.2009.09.001
- Correa NE, Cataño JC, Mejía GL. Outbreak of mesotherapy-associated cuteneous infections caused by mycobacterium chelonae in Colombia. Jpn J Infect Dis. 2010; 63: 143‑145.
- Babacan T, Onat AM, Pehlivan Y, Comez G, Tutar E. A case of the Behcet’s disease diagnosed by the panniculitis. Rheumatol Int. 2010; 30: 1657‑1659. https://doi.org/10.1007/s00296-009-1123-0
- Rallis E, Kintzoglou S, Moussatou V, Riga P. Mesotherapy-induced urticaria. Dermatol Surg. 2010; 36:1355‑1356. https://doi.org/10.1111/j.1524-4725.2010.01639.x
- Orjuela D, Puerto G, Mejía G, Castro C, Garzón MC, García LM, Hernández E, Ribón W, Rodríguez G. Cutaneous tuberculosis after mesotherapy: report of six cases. Biomedica. 2010; 30: 321‑326. https://doi.org/10.7705/biomedica.v30i3.264
- Wongkitisophon P, Rattanackaemakorn P, Tanrattanakorn S, Vachiramon. Cutaneous mycobacterium abscessus infection associated with mesotherapy injection. Case rep dermatol. 2011; 18. https://doi.org/10.1159/000324766
- Galmés-Truyols A, Giménez-Duran J, Bosch-Isabel C, et al. An outbreak of cutaneous infection due to Mycobacterium abscessus associated to mesotherapy. Enferm Infecc Microbiol Clin. 2011; 29: 510‑514. https://doi.org/10.1016/j.eimc.2011.03.006
- Navarte DA, Rosset-Llobet J. Safety of subcutaneous microinjections (mesotherapy) in musicians. Med Probl Perform Art. 2011; 26: 79‑83. https://doi.org/10.21091/mppa.2011.2012
- Ramos A, Roustan G, Lucena JL, Daza RM. Aparición de nódulos subcutáneos después de aplicación de mesoterapia. Enferm Infecc Microbiol Clin. 2011; 29(10): 775‑777. https://doi.org/10.1016/j.eimc.2011.05.008
- Ramos-e-Silva M, Pereira AL, Ramos-e-Silva S, Piñeiro-Maceira J. Oleoma: rare complication of mesotherapy for cellulite. Int J Dermatol. 2012; 51: 162‑167. https://doi.org/10.1111/j.1365-4632.2011.04931.x
- Vukcević NP, Babić G, Segrt Z, Ercegović GV, Janković S, Aćimović L. Severe acute caffeine poisoning due to intradermal injections: mesotherapy hazard. Vojnosanit Pregl. 2012; 69(8): 707‑713. https://doi.org/10.2298/VSP1208707P
- Maggiori E, Bartoletti E, Mammucari M. Intradermal therapy (mesotherapy) with lymdiaral in chronic venous insufficiency and associated fibrosclerotic edema damage: a pilot study. J Altern Complement Med. 2013; 19(9): 777‑781. https://doi.org/10.1089/acm.2012.0734
- Zaragoza J, Delaplace M, Benamara M, Estève E. A rare side effect of mesotherapy: Nicolau syndrome. Ann Dermatol Venereol. 2013; 140(11): 713‑717. https://doi.org/10.1016/j.annder.2013.07.009
- Rodríguez-Gutiérrez G, Toussaint S, Hernández-Castro R, Sánchez-León Mdel C, Arenas R. Nocardia brasiliensis infection: an emergent suppurative granuloma after mesotherapy. Int J Dermatol. 2014; 53(7): 888‑890. https://doi.org/10.1111/j.1365-4632.2012.05649.x
- Güngör S, Kocatürk E, Topal IO. Frontal edema due to topical application of 5% minoxidil solution following mesotherapy injections. Int J Trichology. 2015; 7: 86‑87. https://doi.org/10.4103/0974-7753.160124
- Polat M, Üstün H. A case of mesotherapy-induced panniculitis. Cutan Ocul Toxicol. 2016; 35: 163‑164. https://doi.org/10.3109/15569527.2015.1042110
- Centers for Disease Control and Prevention (CDC). Outbreak of mesotherapy-associated skin reactions--District of Columbia area, January-February 2005. MMWR Morb Mortal Wkly Rep. 2005 Nov 11;54(44):1127-30.
- Mammucari M, Gatti A, Maggiori E, Vergari B, Gafforio P, Tufaro G, Maggiori S. Informed consent and experimental treatments: the case of mesotherapy. Recenti Prog Med. 2013; 104: 214‑217. https://doi.org/10.1701/1291.14279
- Mammucari M, Gatti A, Maggiori S, Bartoletti CA, Sabato AF. Mesotherapy, definition, rationale and clinical role: a consensous report from the Italian Society of Mesotherapy. Eur Rev Med Pharmacol Sci. 2011; 15:682‑694.



